实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为: 2NH3+3CuO
 N2+3Cu+3H2O
N2+3Cu+3H2O
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;d中浓硫酸的作用是 , ;实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 。(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有
(a)m(Cu)和m(CuO) (b)m(N2)和m(H2O) (c)m(Cu)和m(H2O) (d)m(NH3)和m(H2O)
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。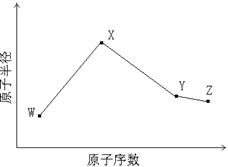
(1)Y在周期表中的位置是。
(2)用电子式解释X与W能形成化合物X3W的原因。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g) 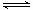 2A(g) △H =-92.4 kJ・mol―1
2A(g) △H =-92.4 kJ・mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mol/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10min |
3.8 |
8.4 |
0.4 |
| 第20min |
3.4 |
7.2 |
1.2 |
| 第30min |
3.4 |
7.2 |
1.2 |
| 第40min |
3.6 |
7.8 |
0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) =;
②反应在第10min改变了反应条件,改变的条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
已知:
I.
II.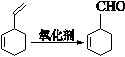
以1、3—丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
请回答:
(1)A的结构简式是;B的结构简式是。
(2)写出下列反应的化学方程式:
反应①,反应④。
某有机化合物经分析,含碳的质量分数为90%,含氢的质量分数为10% 其蒸气相对于氢气的密度为60,则:
I.有机物A的分子式为:
II.经红外光普测知A为苯的同系的,且核磁共振氢普峰面积比为3:2:2:2:3,则其结构简式为:
III.其有机物在一定条件下有下列转化关系如下:
请回答:
①.D中含氧官能团名称:
②.B→F的反应应类型,高分子化合物H的结构简式:
③.E→G的化学方程式:
氮是地球上含量丰富的一种元素,氮元素的单质和化合物在工农业生产、生活中有重要用途。
(1)根据右下能量变化示意图:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,
其平衡常数K与温度T的关系如下表,试判断K1K2(填“>”、“=”或“<”)
| T /K |
298 |
398 |
| 平衡常数K |
K1 |
K2 |
(3)下列各项能说明该反应达到平衡状态的是(填字母序号)
a. v(H2)正="3" v(N2)逆
b. 容器内压强保持不变
c. 容器中混合气体的密度保持不变
d.: N2、H2、NH3的浓度之比为1:3:2
(4)氨气极易溶于水,常用下图实验来验证,在标准状况下,烧瓶中的氨水使酚酞变红。
请回答:
①用化学用语说明所得氨水能使酚酞变红的原因。
②250C时,将一定量的氨水与盐酸混合后pH=7,测该混合溶液中c(Cl-)与c(NH4+)关系为(填字母序号)
a.c(Cl-)﹥c(NH4+)b.c(Cl-)﹦c(NH4+)
c. c(Cl-)﹤c(NH4+) d.无法判断
A、B、C、D、E是中学常见的5种化合物,A、B是金属氧化物且A是红棕色固体,元素X、Y、Z是中学化学中常见的单质,相关物质间的关系如下图所示。
(1)工业上得到单质X的冶炼方法1是。
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3 反应的化学方程式是。
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式。
(4)若试剂2是盐酸。
①如何检验D物质中的金属阳离子。
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因。