我国最新报导的高温超导体中,铊(Tl)是组成的成份之一。已知它是ⅢA族元素,关于铊的性质的判断可能错误的是
| A.铊是银白色、质软的金属 |
| B.Tl(OH)3与Al(OH)3一样具有两性 |
| C.在某化合物中是呈+3价 |
| D.与HNO3作用生成硝酸盐 |
下列事实与胶体性质无关的是
| A.在豆浆里加入盐卤做豆腐 |
| B.河流入海处易形成沙洲 |
| C.一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路 |
| D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是
A.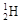 |
B. |
C. |
D.OHCCHO |
化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是
| A.电解质与非电解质属于包含关系 |
| B.化合物与碱性氧化物属于包含关系 |
| C.单质与化合物属于交叉关系 |
| D.氧化还原反应与分解反应属于并列关系 |
下列物质中既能导电,又属于电解质的是
| A.氯化钠溶液 | B.金属铜 | C.熔融硝酸钾 | D.酒精 |
下列物质属于强电解质的是
| A.H2O | B.CO2 | C.CH3COOH | D.CH3COONa |