pg某结晶水合物A·nH2O,受热失去全部结晶水后,质量变动qg,由此可以得到该结晶水合物的分子量为 

向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
| A.3.2 g | B.2.4 g | C.1.6 g | D.0.8 g |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3 NF3+5 H2O="==2" NO+HNO3+9 HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂和氧化剂的物质的量之比是1∶2 |
| C.若生成0.2 mol HNO3,则转移0.2 mol电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
下列说法正确的是
| A.金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 |
| B.氧化剂在反应中失去电子,还原剂在反应中得到电子 |
| C.氧化剂具有氧化性,还原剂具有还原性 |
| D.阳离子只有氧化性,阴离子只有还原性 |
下列对有关实验事实的解释正确的是
| A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42 |
| D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
下列实验设计能够成功的是
| A.检验亚硫酸钠试样是否变质: 试样 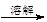 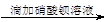 白色沉淀 白色沉淀 沉淀不溶解→说明试样已变质 沉淀不溶解→说明试样已变质 |
| B.除去粗盐中含有的硫酸钙杂质 粗盐 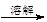 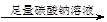     精盐 精盐 |
| C.检验某溶液中是否含有Fe2+ 试样  溶液颜色无变化 溶液颜色无变化 溶液变红色→溶液中含有Fe2+ 溶液变红色→溶液中含有Fe2+ |
| D.证明酸性条件H2O2的氧化性比I2强: |
NaI溶液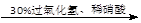
 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2