试回答下列中和热测定的有关问题。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、环形玻璃搅拌棒、0.50mol·L-1盐酸、0.55mol·L-1 NaOH溶液,尚缺少的实验用品是__________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒__________,其原因是______________________________________________。
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容c=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=___________________________________。
A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系。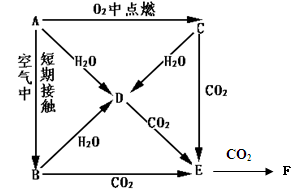
(1) 写出以下物质的化学式:CF
(2) 完成以下离子方程式:
C→D:
D→E:
(3) 等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1ω2 (填“>”或“<”或“==”)。
(4) E中混有少量的F,用化学方程式表示除去F的两种方法:
、
(5) 用m g的D来制取纯净的E,写出最简单的实验方法
L、M、Q、R、X代表五种物质,它们都含某种价态的氮元素,各物质中氮元素的化合价只有一种。物质L中氮元素的化合价比物质M中氮元素的化合价低。在一定条件下,它们会有如下的转化关系(未配平)。
Q + HCl M+Cl2+H2O R+L
M+Cl2+H2O R+L X+H2O R+O2
X+H2O R+O2 L+ H2O
L+ H2O
请判断:
(1) 五种物质按氮元素的化合价从高到低的顺序排列是 ,
若五种物质中有一种是硝酸,那么硝酸应该是(用字母表示)
(2) 某同学写出下面不同价态的氮的化合物相互转化关系(未配平),其中你认为一定不能实现的是( )
A.NO+HNO3 N2O3+H2O B.NH3+NO
N2O3+H2O B.NH3+NO HNO2+H2O
HNO2+H2O
C.N2O4+H2O HNO3 +HNO2
HNO3 +HNO2
(1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
FeSO4 +________ → ________ + ________+________+H2O
(2) 反应物中发生氧化反应的物质是________,被还原的元素是________。
(3) 反应中1 mol氧化剂________(填“得到”或“失去”)________mol 电子。
(4) 请将反应物的化学式及配平后的系数填入下列相应的位置中: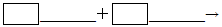
现有m g 某气体,它由四原子分子构成,它的摩尔质量为Mg/mol,则:
(1) 该气体的物质的量为
(2) 该气体所含的原子总数为个
(3) 该气体在标准状况下的体积为
(4) 该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(5) 该气体溶于水后形成VL溶液,其溶液的物质的量浓度为
(每空2分,共14分)某河道两旁有甲乙两厂。它们排放的工业废水中,
共含K+、Ag+、Fe3+、C1-、OH-、NO3-六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是_____________。乙厂的废水中含有另外三种离子。
对于该两厂的废水,可采取下列两种方法来处理。
(1)如果在废水中加一定量(选填:活性炭或铁粉),可以发生反应,离子方程式是,并且能够回收其中的金属(填写金属元素符号)。
(2)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出两个离子方程式: ________________; ____________________。经过滤后的废水主要含,可用来浇灌农田。