反应 在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大④保持压强不变,充入N2使容器体积变大
| A.①④ | B.②③ | C.①③ | D.②④ |
已知甲苯的一溴代物有4种,则甲苯完全氢化后的环烷烃的一溴代物有
| A.3种 | B.4种 | C.5种 | D.6种 |
由-C6H5、-C6H4-、-CH2-、-OH四种原子团各一种组成属于酚类的物质的种类有
| A.3种 | B.4种 | C.1种 | D.2种 |
丁香油酚是一种液体,它的结构简式是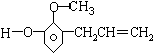 ,丁香油酚不具有的性质是
,丁香油酚不具有的性质是
| A.与Na2CO3反应放出CO2 | B.与烧碱反应 |
| C.与钠反应 | D.能发生氧化反应 |
已知酸性大小:羧酸 > 碳酸 > 酚,下列含溴化合物中的溴原子,在适当条件下都能被—OH 取代(均可称之为水解反应),所得产物能跟NaHCO3溶液反应的是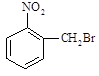
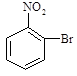
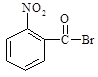
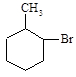
A. B . C. D.
有机物HOOC—CH═CH—CH2—CH═C(CH3)—CH2OH,有关该物质可能具有的性质说法正确的是
| A.能发生取代、加成、氧化、加聚等反应 |
| B.1mol该物质能和2molNaOH反应 |
| C.1mol该物质与Br2等物质的量加成可得到三种产物 |
| D.它与足量H2反应可得分子式为C8H18O3的物质 |