
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、 。
②检查好装置的气密性后加热B前必须进行的操作是 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是 。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是 。
课题式课堂教学是“研究性学习”的方式之一,其基本模式为:提出课题→确定研究方案→解决问题→总结和评价。下页图是关于“CO的化学性质”的课题式课堂教学“解决问题”阶段中,甲同学设计的证明“CO具有还原性”的实验装置。
(1)气体验纯后开始进行实验,实验时应先点燃 处
(填“A”或“B”)的酒精灯。
(2)反应一段时间后,可观察到洗气瓶中的现象为 ,加热的玻璃管里的现象为 。
(3)酒精灯B的作用是 。
(4)乙同学提出甲同学设计的装置太复杂,认为可将酒精灯合二为一,去掉B,而将尾气导管口旋转到A的火焰上即可,乙同学的设计是否合理? (填“合理”或“不合理”),理由是。
(5)丙同学质疑“CO能否使澄清的石灰水变浑浊”,该同学设计CO通入CuO之前,应先通过澄清石灰水,以排除CO与澄清石灰水反应。试对此作出评价,认为丙的设计(填“必要”或“不必要”),理由是
。
(6)丁同学认为甲同学的设计的装置中的尾气处理还可以有其他的方法,请你为丁同学设计一种合理的尾气处理方法
。
实验室配制500 mL 0.1mol·L-1的氢氧化钠溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切。
回答下列问题:
(1)需称量g的氢氧化钠, 氢氧化钠固体应放在仪器中称量。
(2)上述步骤的正确操作顺序是(填序号)。
(3)上述实验,除用到托盘天平、500mL容量瓶 、烧杯、胶头滴管、药匙外,还用到。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: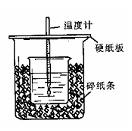
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是。
(2)烧杯间填满碎纸条的作用是。
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”)。
下表是元素周期表的一部分,回答下列有关问题: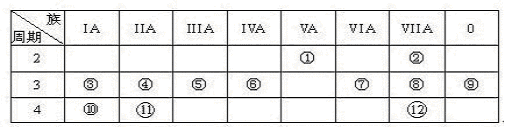
(1)写出下列元素符号:①________,⑥________,⑦________
(2)画出原子的结构示意图:④__________,⑧__________
(3)元素⑦与元素⑧相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是()
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)第三周期(除稀有气体元素)中原子半径最大的元素是(填序号),跟它同周期原子半径最小的元素是(填序号),它们可以形成(填离子或共价)化合物,用电子式表示其形成过程下:
(5)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,该化合物是(填分子式)分子的空间构型为:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
⑴方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是。
⑵方案二:按下图装置进行实验。并回答以下问题。
①实验前先_____________________。分液漏斗中应该装_____(盐酸或硫酸)。D装置的作用是。
②实验中除称量样品质量外,还需称___________装置前后质量的变化。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是。
⑶方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤、洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯外还用到的玻璃仪器有_______________;
②实验中判断沉淀是否完全的方法是 。
③如加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为____________(计算结果保留两位有效数字)。