进行下列反应后,所得溶液中一定只含一种溶质的是( )
| A.向MgSO4、H2SO4的混合溶液中加入过量的氢氧化钡溶液 |
| B.Fe3O4溶于适量的稀盐酸中 |
| C.向稀盐酸中滴入少量的NaAlO2溶液 |
| D.NaOH溶液与CH3COOH溶液反应后所得到的pH>7的溶液 |
下列反应原理不符合工业冶炼金属实际情况的是
下列实验事实所引出的相应结论正确的是
| 选项 |
实验事实 |
结论 |
| A |
Na2S2O3溶液与稀H2SO4溶液混合时,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 |
当其他条件不变时,增大反应物浓度化学反应速率加快 |
| B |
在化学反应前后,催化剂的质量和化学性质都没有发生改变 |
催化剂一定不参加化学反应 |
| C |
将NH4Cl晶体与Ba(OH)2.8H2O晶体混合后研磨,烧杯壁温度降低 |
该反应为吸热反应 |
| D |
在容积可变的密闭容器中发生反应 H2(g)+ I2(g) 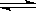 2HI(g), 2HI(g),把容积缩小一倍 |
正反应速率加快,逆反应速率不变 |
根据碘与氢气反应的热化学方程式
①I2(g)+ H2(g)  2HI(g)△H= -9.48 kJ/mol
2HI(g)△H= -9.48 kJ/mol
②I2(s)+ H2(g) 2HI(g) △H=" +26.48" kJ/mol
2HI(g) △H=" +26.48" kJ/mol
下列判断正确的是
| A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应①的产物比反应②的产物稳定 |
| D.反应②的反应物总能量比反应①的反应物总能量低 |
已知一定温度和压强下,N2(g)和H2(g)反应生成2mol NH3(g),放出92.4kJ热量。在同温同压下向密闭容器中通入1mol N2和3mol H2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5mol N2和1.5mol H2,相同温度下达到平衡时放出热量为Q2kJ。则下列叙述正确的是
| A.2Q2>Q1=92.4kJ | B.2Q2=Q1=92.4kJ |
| C.2Q2<Q1<92.4kJ | D.2Q2=Q1<92.4kJ |
在一定温度下,向一个容积可变的恒压容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是
| A.第一次实验平衡时反应放出的热量为98.3kJ |
| B.第一次实验平衡时SO2的转化率比第二次实验平衡时SO2的转化率大 |
| C.第二次实验达平衡时SO3的体积分数大于2/9 |
| D.两次实验平衡时,SO3的浓度相等 |