下列说法正确的是( )
| A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体; 甲醇、乙二醇和丙三醇互为同系物 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.HI的相对分子质量大于HF,所以HI的沸点高于HF |
| D.由IA族和VIA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含有 |
共价键的离子型化合物
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是()
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
下列说法错误的是()
| A.气态电中性基态原子失去电子转化为气态基态正离子需要的最低能量叫做第一电离能 |
B.当碳原子的核外电子排布由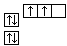 转变为 转变为 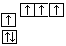 时,碳原子要向外界环境吸收能量 时,碳原子要向外界环境吸收能量 |
| C.电负性的大小也可以作为判断金属性和非金属性强弱的尺度 |
| D.同主族元素从上到下第一电离能逐渐变小 |
σ 键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道以及一个原子的p轨道和另一个原子的p轨道以“头碰头”方式重叠而成。则下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是()
| A.H2 | B.HCl | C.Cl2 | D.F2 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是()
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH+O2=CH3COOH+H2O |
| D.正极上发生的反应是:O2+4e-+2H2O=4OH- |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )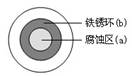
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe 2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2+ Cu2+ |