当线型高分子链上如果还有能起反应的官能团时,在一定条件下就会形成体型高分子结构。下列有机物在一定条件下通过反应最终可能得到体型结构的高分子化合物的是( )
| A.CH2=CH2 | B.CH3COOH |
| C.CH2=CHClC=CH2 | D.CH2=CHCH2OH |
R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
| A.1 | B.2 | C.3 | D.4 |
下列物质中,在一定条件下既能发生银镜反应,又能发生水解和氧化反应的是
| A.甲酸乙酯 | B.溴乙烯 | C.乙酸甲酯 | D.苯甲醛 |
已知瘦肉精(盐酸克伦特罗)的结构简式为:

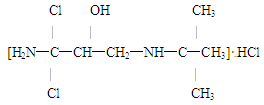
下列有关说法不正确的是
| A.瘦肉精的化学式为C12H19Cl3N2O | B.瘦肉精属于芳香族化合物 |
| C.瘦肉精一定条件下能发生消去反应 | D.处于同一平面上的原子最多有10个 |
下列物质性质的比较,正确的是
| A.热稳定性:Na2CO3>NaHCO3>H2CO3 | B.熔点:K>Na>Li |
| C.溶解度:NaHCO3>Na2CO3 | D.氧化性:Li+<Na+<K+ |
实验室制取少量N2常利用的反应是NaNO2+NH4Cl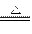 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
| A.NaNO2是氧化剂 | B.生成 1 mol N2时转移的电子数是6 mol 1 mol N2时转移的电子数是6 mol |
| C.NH4Cl中的N元素被还原 | D.N2既是氧化剂又是还原剂 |