丁烷催化裂化,其碳链按两种方式断裂,生成两种烷烃和两种烯烃。若丁烷的裂解率为90%,且裂解后两种烯烃的质量相等,则裂解后得到的相对分子质量最小的气态烃在混合气体中的体积分数为( )
| A.11% |
| B.19% |
| C.40% |
| D.50% |
下列指定溶液中,各组离子可能大量共存的是()
| A.pH=1的溶液中:K+、Fe2+、C1—、NO3— |
| B.加入Al能放出H2的溶液中:NH4+、SO42—、C1—、HCO3— |
| C.在含有大量Fe3+的溶液中:NH4+、C1—、Na+、SCN— |
| D.由水电离的c(OH—)=10—13mol·L—1的溶液中:Ba2+、Na+、C1—、Br— |
下列说法正确的是()
| A.13C与14C属于同一种元素,它们互为同位素 |
| B.淀粉、明矾属于纯净物,矿泉水、食醋属于混合物 |
| C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| D.通过滤纸过滤可以得到Fe(OH)3胶体中的分散质粒子 |
实验是研究化学的基础,下列图中所示的实验方法、装置或操作中正确的是( )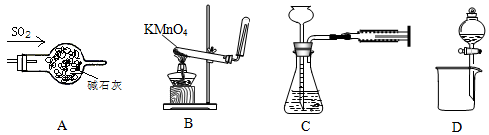
| A.干燥SO2 | B.实验室制取并收集O2 |
| C.装置气密性的检查 | D.分离乙醇和乙酸的混合液 |
下列离子方程式书写正确的是 ( )
| A.少量的CO2通入NaOH溶液中:CO2+OH—=HCO3— |
| B.小苏打溶液中加入醋酸溶液:HCO3—+H+=CO2↑+H2O |
C.硫化钠水解的离子方程式:S2—+2H2O  H2S+2OH- H2S+2OH- |
| D.铜粉加入到FeCl3溶液中:Cu+2Fe3+=2Fe2++Cu 2+ |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.标准状况下,22.4LNO与11.2L O2充分反应后得到的气体分子数为NA |
| B.3.6g重水中含有的中子数为2NA |
| C.一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2NA |
| D.常温下,1L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA |