(9分)下图所涉及的物质均为中学化学中的常见物质, 其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如图转化关系,反应中生成的水及次要产物均已略去。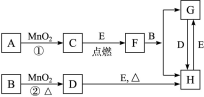
(1)写出有关物质的化学式:
F______,G______,H______。
(2)指出MnO2在相关反应中的作用,反应①中是______剂,反应②中是______。
(3)若反应①是在加热条件下进行,则A是______;若反应①是在常温条件下进行,则A是______。
(4)写出B与MnO2共热获得D的离子方程式________________________________。
(5)写出B与F反应的化学方程式_______________________________________。
化学与人类生活密切相关。请按要求,回答下列问题:
(1)漂白粉有效成分的化学式为 ,其能消毒杀菌是因有强 性。
(2)KAl(SO4)2•12H2O的俗名为 ,因其溶于水生成 而具有净水作用。
(3)酸雨的pH小于 ,含亚硫酸的酸雨久置后pH (增大、减小或不变)。
(4)小苏打可用于治疗胃酸过多,其反应的离子方程式为 。
下图所示装置可用于多种实验。
(1)实验室可利用该装置来制取氯气,发生反应的化学方程式为:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
①用双线桥标出上述反应中的电子转移情况。
②B装置的作用是___________________,C装置中盛装的液体最好是 。
③若按上述反应制得的氯气体积为4.48 L(标准状况),则实际反应中消耗12 mol/L盐酸的体积大于理论值__________mL。
(2)在实验室要测定部分变质的过氧化钠的纯度,也可用上图装置中的部分仪器。
①上述装置中多余的仪器是_____________(填A、B、C、D等序号)。 ②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
③若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为___________。
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液。向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如下图所示。
请回答下列问题:
(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸时发生反应的离子方程式为
, ;
(2)混合溶液中Na2CO3和NaHCO3的物质的量之比为 ;
(3)原NaOH溶液中NaOH的物质的量浓度为 ,所通CO2气体的体积在标准状况下为 。
味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C 5 H 8 NO 4 Na)。谷氨酸钠有鲜味,易溶于水。某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量<20%”。
某学校化学科研小组对此味精中NaCl的含量进行测定。
Ⅰ.查阅资料:谷氨酸钠的存在不影响NaCl含量的测定。
Ⅱ.设计实验方案:
(1)实验原理:通过味精与硝酸银反应生成氯化银的质量计算该味精中NaCl的质量分数。
(2)实验试剂:水、AgNO 3 溶液等
(3)实验过程:
①操作(Ⅰ)所需要的玻璃仪器有____________________。
②通过计算判断该味精中NaCl的质量分数是__________,判断该味精中NaCl__________(填“符合”或“不符合”)其包装上标注的标准。
③若溶液A的体积为50 mL,则其中NaCl的物质的量浓度为____________________。
某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题:
(1)请写出Fe2O3与①反应的离子方程式______________________________。
(2)物质②为_______________。
(3)请写出FeCl3与铁粉反应的化学方程式________________________。
(4)向FeCl2溶液中滴加NaOH溶液最终生成Fe(OH)3浊液,该过程的现象为_________,此过程中发生的氧化还原反应为(用化学方程式表达)________________________。
(5)将FeCl3饱和溶液滴入沸水中,并继续煮沸至红褐色,制得分散系③__________________,它与FeCl3溶液、Fe(OH)3浊液的本质区别是__________ ______。