(8分)有一瓶澄清的溶液,其中可能含有K+、Na+、Ba2+、Mg2+、Fe3+、Cl-、CO、SO,取该溶液进行如下实验:
(1)取pH试纸检验,表明溶液呈强酸性,排除________存在。
(2)另取部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则可排除________、________离子的存在。
(3)取上述碱性溶液加Na2CO3溶液,有白色沉淀生成,可排除________离子的存在。
(4)根据以上实验事实确定:该溶液中肯定存在的离子是________、________;可能存在的离子是________、________。
A、B、C、D四种芳香族化合物的结构简式如下所示: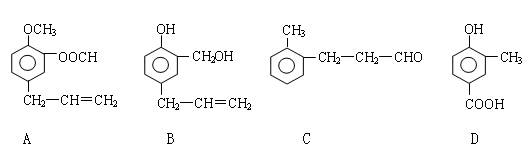
请回答下列问题:
(1)写出A中无氧官能团的名称 ;D中含氧官能团的结构简式为 。
(2)用A、B、C、D填空:能发生银镜反应的有 ;既能与FeCl3溶液发生显色反应又能与Na2CO3溶液反应放出气体的是 。
(3)按下图C经一步反应可生成E,E是B的同分异构体,
则反应①的反应类型为 ;写出反应②的化学方程式: 。
(4)G、H和D互为同分异构体,它们具有如下特点:
① G和H都是苯的二元取代物,这两个取代基分别为羟基和含有-COO-结构的基团;
② G和H苯环上的一氯代物有两种不同结构;
③ G可以发生银镜反应,H分子中苯环不与取代基碳原子直接相连 。
写出G和H的结构简式:G: ;H: 。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。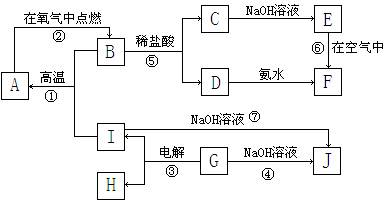
请填写下列空白:
(1)I、G、J三种物质中所含同一种元素在周期表中位置第_______周期、第_______族;
(2)写出反应⑥的化学方程式____________________;
(3)写出反应④的离子方程式____________________;
(4)若28g A单质在足量的氧气中灼烧,反应放出的热量为Q kJ(Q > 0),写出这个反应的热化学方程式:;
(5) 反应⑦中若有18g I参与反应,则转移电子数为NA。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是: △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。
①X的化学式为;
②右图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③若升高温度,达新平衡时,平衡常数将__________(填增大或减小或不变)。
④改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号);
(2)常温下氨气极易溶于水,其水溶液可以导电。
⑤用方程式表示氨气溶于水且显弱碱性的过程:
;
⑥氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑦将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为。
芬必得是一种解热、镇痛及抗生素类药物的商品名,其主要成分是化合物对异丁基-α-甲基苯乙酸,药名为布洛芬,它有多种合成路线,下面是一种合成方法: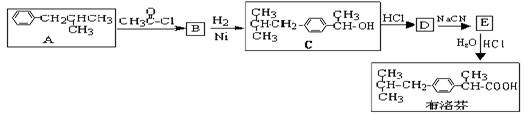
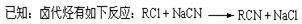 ,
,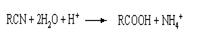
回答下列问题:
(1)写出有机物B、D的结构简式:BD
(2)写出反应类型:A→BB→C
(3)有机物C和苯酚的关系是(填选项字母)
A 、互为同分异构体 B、互为同系物
C、均属于芳香族化合物D、均属于芳香醇类
(4)根据布洛芬结构,下列判断不正确的是(填选项字母)
A、芳香族化合物 B、苯甲酸的同系物
C、能与溴水发生加成反应而使溴水褪色 D、能使酸性高锰酸钾溶液褪色
(5)与A具有相同分子式,且苯环上只有一个取代基的有机物共有四种,写出除A外的其余三种的结构简式:,,
(6)写出由E生成布洛芬的化学方程式:
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)
| 阳离子 |
K+、Na+、Ba2+、NH4+ |
| 阴离子 |
CH3COO—、Cl—、OH—、SO42— |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B的溶液中水的电离程度相同;D溶液焰色反应显黄色。
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是
(2)写出C溶液和D溶液反应的化学方程式
(3)25℃时pH=9的A 溶液和pH=9的C溶液中水的电离程度小的是 (填写A或C的化学式)
(4)25℃时用惰性电极电解D的水溶液,一段时间后溶液的pH 7;(填>、< 或=)
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为
(6)室温时在一定体积0.2mol·L—1的C溶液中,加入一定体积的0.1mol·L—1的盐酸时,混合溶液的pH=13,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是