现有X、Y、Z、W四种短周期元素原子序数依次增大,其原子半径及主要化合价如下表所示。又知X与Y、Z与W分别位于同一周期,Y、W处于同一主族。
| 元素 |
X |
Y |
Z |
W |
| 原子半径/nm |
0.077 |
0.074 |
0.186 |
0.102 |
| 主要化合价 |
-4,+4 |
-2 |
+1 |
-2,+6 |
请回答: X位于元素周期表的 ,画出Z原子结构示意图 ,
Z2W是离子晶体,写出其电子式 。X单质能与某酸(H2WY4)的浓溶液发生反应,产物有XY2、WY2和水,
其反应的化学方程式为;Z2Y2可与XY2发生反应可给潜水艇供氧,其反应的化学方程式为;
若反应中转移电子数为3.01×1023,则所得气体产物的体积是(标准状况)。Y、Z、W三种元素可组成质量比为5.75 : 8 : 4的某种化合物。实验室检验该化合物中所含阴离子的操作方法及有关实验现象是:取少量含该阴离子的溶液,,则证明原溶液中含有该阴离子。
常见的10电子微粒中,分子有:_____________________(只举一例,下同),
阳离子有_________________________,阴离子有_________________________;
常见的18电子微粒中,分子有__________________________,
阳离子有___________________________,阴离子有_________________________。
H、D、T的中子数分别是_________,质量数分别是_____________,
同位素原子的虽然不同,但______________基本上完全相同;
16O、17O、18O属____________,O2、O3、O4属________________,
某元素的同位素原子可以形成3种分子量不同的双原子分子,
则该元素有_________种同位素原子。
在元素周期表中周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族; 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
.酒石酸是某种降压药物的载体,可用1,3-丁二烯为原料合成,其流程如下: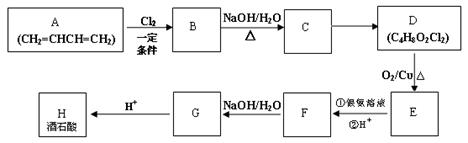
已知:①
② D的分子组成是C4H8O2Cl2,核磁共振氢谱显示其有三个峰。
(1)D中所含官能团的名称是。
(2)C转化为D的反应类型是。
(3)B存在顺反异构,它的顺式结构简式是。
(4)写出A生成B的化学方程式。
(5)与C组成相同、属于酯类、能发生银镜反应的有机化合物的结构简式。
(6)F转化为G的化学反应方程式是。
(7)F与乙二醇在一定条件下可以发生缩聚反应,该反应的化学方程式是___________。