NaNO3 KNO3 NaCl KCl
10℃ 80.5 20.9 35.7 31.0
100℃ 175 246 39.1 56.6
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取0.120 mol KCl和0.110 mol NaNO3,加70.0 g H2O,加热溶解。在100℃时蒸发掉 50.0 g H2O,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温)。
将滤液冷却至10 ℃,待充分结晶后过滤。计算所得晶体的质量(m低温)。
两种气态烃A、B组成的混合气体完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示,则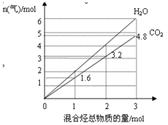
(1)混合烃中n(C):n(H)=
(2)混合烃中一定有
(3)若相对分子质量A<B,试推断混合气体中A和B所有可能的组合及其物质的量之比,并将结果填入下表WWW.K**S*858$$U.COM(有几组填几组,不一定填满)
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的物质的量比 |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
|||
| ⑤ |
已知Cl2在70℃的NaOH溶液中,能同时发生两个反应:
Cl2 + 2NaOH =" NaCl" + NaClO + H2O;3Cl2 + 6NaOH =" 5NaCl" + NaClO3 + 3H2O
反应完后,测得溶液中NaClO和NaClO3的物质的量之比为4∶1。现有49.7g Cl2,将其通入到足量的70℃的NaOH溶液中,充分反应后得500mL溶液。计算完全反应后各生成物的物质的量浓度(不计算水的量)。
在温度为373K时,把0.25moi NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g)  N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
(1)开始时2s内以c (NO2)的变化表示的反应速率是多少?
(2)达到最大限度时体系内的压强是开始的多少倍?
已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l );△H = -571.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g );△H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比.
在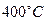 时,将
时,将 和
和 压入一个盛有催化剂的
压入一个盛有催化剂的 密闭容器中进行反应(
密闭容器中进行反应(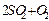

 ),2分钟时容器中剩下
),2分钟时容器中剩下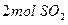 和
和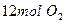 。则:
。则:
(1)2分钟内生成的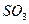 的物质的量是多少?
的物质的量是多少? 起始的物质的量是多少?
起始的物质的量是多少?
(2)2分钟内以 浓度变化表示的平均反应速率是多少?以
浓度变化表示的平均反应速率是多少?以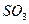 浓度变化表示的平均反应速率又是多少?
浓度变化表示的平均反应速率又是多少?