甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:
CH3OH(g) 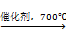 CH2O(g) + H2(g)
CH2O(g) + H2(g) 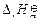 =" 84.2" kJ·mol-1 ⑴
=" 84.2" kJ·mol-1 ⑴
向体系中通入空气,通过以下反应提供反应(1) 所需热量:
H2(g) + 1/2O2(g)=H2O(g) 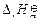 =" –241.8" kJ·mol-1 (2)
=" –241.8" kJ·mol-1 (2)
要使反应温度维持在700℃,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。
在加热条件下,用MnO2与足量浓盐酸反应,制得氯气0.56L(标准状况)。
MnO2+4HCl(浓)=== MnCl2+Cl2↑+2H2O
问:(1)理论上需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
已知CuO在高温下会发生分解反应,产物为Cu2O和O2,试回答下列问题:
(1)写出CuO在高温下会发生分解反应的化学方程式,并用双线桥法标明电子的转移方向及数目。
(2)如果反应在标准状况下有11.2 L的O2生成,试计算反应中转移电子的物质的量为mol(须列出简单的计算过程)。
(3)已知向Cu2O中加入稀H2SO4可得到蓝色溶液和红色固体,请写出其反应的离子方程式,
计算题:(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:2SO2 (g) + O2(g)  2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) 已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态 肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)="===2" NO2(g);△H="+67.7" kJ·mo l-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
l-1, N2H4(g)+O2(g)="==" N2(g)+2H2O (g);△H="-534" kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式________________________________________。
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是:。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是。