下列八种物质既能使高锰酸钾酸性溶液褪色又能与溴水反应使之褪色的是( )
①甲烷 ②苯 ③聚乙烯 ④2丁炔 ⑤环己烷 ⑥邻二甲苯 ⑦裂解气
| A.③④⑦ | B.④⑥⑦ | C.④⑦ | D.③④⑥⑦ |
下列说法不正确的是
A.NH3·H2O NH4++OH-达到平衡后,升高温度平衡正向移动 NH4++OH-达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
下列与含氯化合物有关的说法正确的是
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子 |
下列图示与对应的叙述相符的是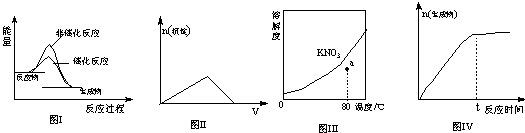
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示表示向KAl(SO4)2溶液中滴加Ba(OH)2溶液产生沉淀的物质的量(n)随氢Ba(OH)2溶液体积(V)的变化 |
| C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D.图Ⅳ表示某可逆反应生成物的物质的量随反应时间变化的曲线,t时刻反应正速率最大 |
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是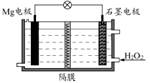
| A.Mg电极是该电池的正极 |
| B.石墨电极附近溶液的pH增大 |
| C.H2O2在石墨电极上发生氧化反应 |
| D.溶液中Cl-向正极移动 |
下列有关说法正确的是
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 |