用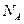 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.32g氧气和臭氧的混和气体中含有的氧原子数为2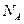 |
B.标准状况下,22.4 L CH3CH2Br中所含分子数为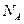 |
C.0.1 mol H3O+所含质子数为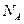 |
D.0.1 mol Fe和足量的稀硝酸充分反应,转移电子数为0.2 |
下列说法正确的是( )
| A.煤、石油、天然气是当今世界上最重要的三大矿物燃料,是取之不尽的 |
| B.煤是由无机物和有机物所组成的复杂的混合物,主要含有碳和氢两种元素 |
| C.石油主要含有碳和氢两种元素,同时还含有少量的硫、氧、氮等元素 |
| D.煤和石油都是由古代植物遗体埋在地层下或在地壳中经过一系列非常复杂的变化而形成的 |
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
下列关于工业生产说法错误的是( )
| A.在侯氏制碱工业中,向饱和氯化钠溶液中先通入氨气,后通入二氧化碳 |
| B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D.工业上采用电解熔融氯化铝的方法制取金属铝 |
某地农田土壤胶体的胶粒带负电荷,若在该农田里施加含氮量相等的下列化肥,有效成分利用率最差的是( )
| A.(NH4)2SO4 | B.NH4HCO3 | C.NH4NO3 | D.NH4Cl |
“节能减排、低碳生活”已经走进百姓生活、城市建设以及经济发展等各个领域,下列有关说法不正确的是( )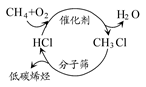
| A.太阳能、地热能、核能等均属于“新能源” |
| B.“低碳”是指采用含碳量低的烃类化合物作燃料 |
| C.上图中甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”的思想 |
| D.减少化石能源的使用能减少CO2的排放量 |