作为重要的工业三酸之一,硝酸通常有以下两种制取方法:
I.硝酸盐与浓硫酸反应: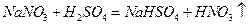
II.氨的催化氧化法,其主要步骤为:①氨的催化氧化;②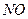 氧化成
氧化成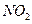 ;③水吸收
;③水吸收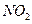
生成硝酸。
(1)方法l中不能加强热,其原因是 。(2)写出方法Ⅱ中步骤①的化学反应方程式 。(3)采用方法Ⅱ制取硝酸,若经过多次循环后,步骤②、③中氮元素的总利用率是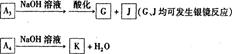
90%,某化工厂用1 t氨气制得5t63%的硝酸溶液,求步骤①中氨气的转化率?(书写计算过程,结果精确到0.1%)
(6分)现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3;②NaHCO3;③NaAlO2;④CH3COONa;⑤NaOH,已知:CO2+3H2O+2AlO2-= 2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是:(填编号);
(2)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是:(填编号);
(3)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:。
(10分)化学电池是将化学能转变成电能的装置,包括一次电池、二次电池和燃料电池等几大类。燃料电池是目前正在探索的一种新型电池,已经使用的氢氧燃料电池的基本反应是:
X极:O2+2H2O+4e-=4OH- Y极:2H2+4OH—=4H2O+4e- 请回答下列问题 :
(1)X是极;Y极发生反应(填“氧化”或“还原”)
(2)该电池总反应方程式为
(3)若反应后的得到5.4 g液态水,此时氢氧燃料电池转移的电子数为。
(4)实验室用铅蓄电池作电源电解饱和食盐水,若制得Cl20.30 mol,电池内至少消耗H2SO4mol。
(7分)常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示
,,。
(2)该溶液中,浓度为0.01 mol/L的粒子是,浓度为0.002 mol/L的粒子是。
(3)和两种粒子物质的量之和等于0.01 mol。
(7分)(1)用系统命名法给下列物质命名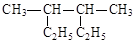 名称:
名称: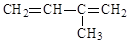 名称:
名称:
(2)分子式为C5H10的烯烃的结构有种,其中有三个—CH3的结构简式为:。 一氯丁烯的同分异构体有8种,分子里含有
一氯丁烯的同分异构体有8种,分子里含有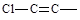 结构的有种
结构的有种
在恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) C(g)+D(g),所得实验数据如下表:
C(g)+D(g),所得实验数据如下表:
| 实验 编号 |
温度/℃ |
起始时物质的量/mol |
平衡时物质的量/mol |
||
| n(A) |
n(B) |
n(D) |
|||
| ① |
700 |
0.40 |
0.10 |
0.090 |
|
| ② |
800 |
0.10 |
0.40 |
0.080 |
|
| ③ |
800 |
0.20 |
0.30 |
a |
|
| ④ |
900 |
0.10 |
0.15 |
b |
请回答下列问题
(1)表中 2(选填“>”、“=”或“<”)
2(选填“>”、“=”或“<”)
(2)800℃时,若起始时向该容器中充入0.5molA(g)、1.0molB(g)、0.3molC(g)、1.8molD(g),则反应开始时的反应速率 v (正)v (逆) (选填“>”、“=”或“<”)。
(3)实验③中,达到平衡时X的转化率为多少?(写出解题过程)