在中学化学实验室中,可通过下图的方法制得一种常见的有毒气体 。
。

 是黑色粉末,
是黑色粉末, 是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
(1)写出 与W的浓溶液共热生成
与W的浓溶液共热生成 的离子方程式 。
的离子方程式 。
(2)  与
与 混合后共热可产生一种无毒气体,反应的化学方程式为 。
混合后共热可产生一种无毒气体,反应的化学方程式为 。
下图是实验室常见的气体发生装置,此反应应选用的发生装置是 (填字母编号)。实验过程中,检验气密性之后(气密性良好),向该装置中加入粉末状固体的操作是: 。
(3)  与乙烯加成可得一种有机物,为验证该有机物中含有与
与乙烯加成可得一种有机物,为验证该有机物中含有与 相同的元素,请选择合适的试剂 (用字母编号回答)。
相同的元素,请选择合适的试剂 (用字母编号回答)。
a.稀盐酸 b.稀硝酸 c.稀硫酸 d.氢氧化钠溶液
e.硝酸银溶液 f.淀粉溶液 g.碘化钾溶液 h.品红溶液
(4)在实验室中制取气体 时,通常可用排某种溶液的方法收集
时,通常可用排某种溶液的方法收集 ,则该溶液是 ;也可用排空气集气法收集
,则该溶液是 ;也可用排空气集气法收集 ,若用右图装置(不能改变瓶口朝向),则气体应该从 (填“m”或“n”)口进。
,若用右图装置(不能改变瓶口朝向),则气体应该从 (填“m”或“n”)口进。
(5)有人设想利用原电池原理以 和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入
和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入 的电极为原电池的 极,其电极反应式为 。
的电极为原电池的 极,其电极反应式为 。
应用下列装置,在硬质破璃管中放入还原铁粉和石棉绒的混合物加热,并通过水蒸气,就可以完成“高温下Fe与水蒸气的反应实验”。
请完成该实验中的问题:
(1)写出该反应的化学方程式: ;该氧化还原反应的氧化剂是 。
(2)实验前必须对整套装置进行的操作是 。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)检验溶液中是否含有三价铁离子用 溶液(写化学式),现象是 。
某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过程如下图所示:
阅读上述实验过程,完成下列填空:
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格A、B、D下填写装置中所放的化学药品。
| A |
→ |
B |
→ |
C |
→ |
D |
| 溶液甲 |
(2)萃取所需要的主要玻璃仪器是_______________;
(3)溶液甲中通入Cl2的化学方程式为 ;
(4)原固体样品中氯化钠的质量分数为__________________。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.
Ⅰ.铁矿石中含氧量的测定
①按如图组装仪器, ;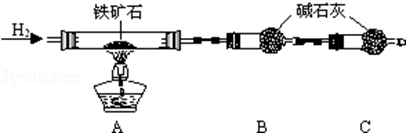
②将10.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)补全步骤①的操作 .
(2)装置C的作用为 .
(3)测得反应后装置B增重2.7g,则铁矿石中氧的质量百分含量为 .
Ⅱ.
(1)步骤④中煮沸的作用是 .
(2)下列有关步骤⑥的操作中说法正确的是 .
a.滴定管用蒸馏水洗涤后可以直接装液
b.锥形瓶不需要用待测液润洗
c.滴定过程中,眼睛注视滴定管中液面变化
d.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(3)若滴定过程中消耗0.5000mol•L﹣1的KI溶液25.0mL,则铁矿石中铁的质量百分含量为 .
某课外活动小组用如图装置进行实验,试回答下列问题。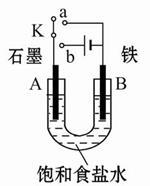
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述(2)实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。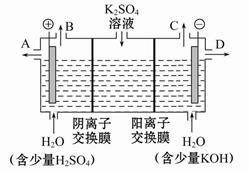
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供艇员呼吸之用,它与二氧化碳反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
(1)A中制取CO2的装置,应为下列图①、②、③中的图________________。
B装置的作用是_ 。为了检验E中收集到的气体,在取出集气瓶后, 。
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:________________。
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43 g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值__________(填“大”或“小”),相差约________mL(取整数值,所用数据均在标准状况下测定),这是由于__________________________。