在100 g浓度为5.26 mol·L-1的酒精溶液中,加入100 g的水后,所得酒精溶液的物质的量浓度( )
| A.大于2.63 mol·L-1 | B.小于2.63 mol·L-1 |
| C.等于2.63 mol·L-1 | D.无法确定 |
下列物质的沸点最高的是()
| A.H2O | B.H2S | C.I2 | D.HF |
下列说法正确的是()
| A.活化分子相互碰撞即可发生化学反应 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率 |
| C.某一反应的活化分子百分率是个定值 |
| D.浓度增大使得反应物分子中的活化分子百分率增大 |
下列各组分子中,均含有非极性键且属于非极性分子的是 ( )
| A.Cl2 C2H4 | B.C2H2NH3 | C.CO2H2S | D.NH3 H2O2 |
下列各组离子在溶液中能大量共存,且能与铝反应放出H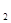 的是()
的是()
A.Na+、H+、Ba2+、NO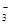 |
B.K+、Mg2+、Cl—、0H— |
C.H+、Mg2+、HCO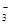 、SO 、SO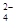 |
D.Ba2+、Cl—、NO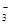 、0H— 、0H— |
能在水溶液中大量共存的一组离子是()
| A.H+、Fe2+、NO3-、SiO32- | B.Ag+、Fe3+、Cl-、SO42- |
| C.K+、SO42-、Cu2+、NO3- | D.NH4+、OH-、Cl-、HCO3- |