分子式为C5H12O的一元醇有多种同分异构体,其中主链上碳原子数为3的同分异构体数目为m,主链上碳原子数目为4的同分异构体数目为n。下列关于m、n的数值正确的是( )
| A.m="1" n="4" | B.m="1" n="5" | C.m="2" n="5" | D.m="2" n=5 |
贝诺酯是解热镇痛抗炎药,其结构如图所示。下列有关说法正确的是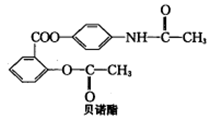
| A.分子式为C17H14O5N |
| B.在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C.1 mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D.贝诺酯既属于酯类又属于蛋白质类 |
下列对于25℃时pH为12的氨水,叙述正确的是
| A.由水电离的c(OH—)=1.0×10-2mol·L-1 |
B.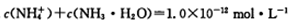 |
C.与等体积、pH=2的盐酸混合后所得的溶液中: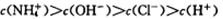 |
D.加入一定量pH=2的醋酸溶液混合后所得的溶液中: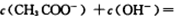 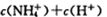 |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是
A.电解时发生反应的化学方程式为: |
| B.由NaClO3溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的成分为NaClO3和NaOH |
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是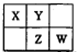
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |
镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是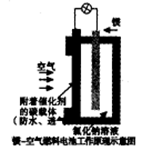
| A.该电池Mg作负极,发生还原反应 |
B.该电池的正极反应式为: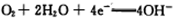 |
| C.电池工作时,电子通过导线由碳电极流向Mg电极 |
| D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L |