目前用乙烯制乙醛的过程分三步进行:
①CH2==CH2+PbCl2+H2O CH3CHO+2HCl+Pb
CH3CHO+2HCl+Pb
②Pb+2CuCl2 PbCl2+2CuCl
PbCl2+2CuCl
③2CuCl+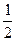 O2+2HCl
O2+2HCl 2CuCl2+H2O
2CuCl2+H2O
下列叙述正确的是( )
| A.CH2==CH2是还原剂,PbCl2是氧化剂 | B.CuCl是还原剂,O2是氧化剂 |
| C.乙烯是还原剂,O2是氧化剂 | D.PbCl2和CuCl2都是氧化剂 |
已知:2SO2(g)+ O2(g) 2SO3(g) △H=-QKJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:
2SO3(g) △H=-QKJ/mol,在温度一定、容积为2L的密闭容器中分别进行下列三个实验:
| 实验编号 |
SO2(g) |
O2(g) |
SO3(g) |
| 1. |
2mol |
1mol |
0mol |
| 2. |
1mol |
0.5mol |
1mol |
| 3. |
1mol |
0.8mol |
1.4mol |
充分作用后,测得实验1反应放出的热量为Q1KJ,实验2没有热量变化,则下列说法中不正确的是()
A. 实验1放出的热量值为Q1=0.5Q B. 该条件下的平衡常数为:4
C. 实验1中O2的转化率为:50% D. 实验3反应放出热量
在密闭容器中进行反应:X2(g)+Y2(g)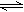 2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
2Z(g)。已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L 、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度不可能是
| A.Z为0.3mol/L | B.Y2为0.35mol/L | C.X2为0.15mol/L | D.Z为0.4mol/L |
可逆反应A(g)+B(g) 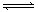 2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的()
2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的()
| A.m>n | B.m<n | C. m=n | D.无法比较 |
今有X(g)+Y(g) 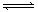 2Z(g)△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的()
2Z(g)△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的()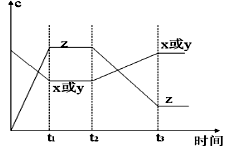
| A.增大X或Y的浓度 | B.增大压强 | C.增大Z的浓度 | D.升高温度 |
高温下,某反应达到平衡,平衡常数K=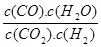 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |