有3个热化方程式:H2(g)+1/2O2(g)=H2O(g);△H ="a" kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H =bkJ/mol
2H2(g)+O2(g)=2H2O(l);△H =ckJ/mol
关于它们的下列表述正确的是( )
| A.a+b=c |
B.1mol H2O由气态变为液态吸收(a-b)kJ热量 |
C.氢气的燃烧热为c/2 kJ |
| D.1molH2 O由液态变为气态吸收l c/2-al kJ热量 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2===2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
| c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
|
| ① |
1.0 |
1.0 |
1.0k |
| ② |
2.0 |
1.0 |
4.0k |
| ③ |
2.0 |
4.0 |
8.0k |
由此可推得,m、n值正确的是
A.m=2,n=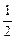 |
B.m=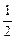 ,n= ,n=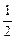 |
C.m=2,n="1" | D.m=1,n=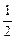 |
在一密闭容器中进行如下反应:2SO2(g) +O2(g)  2SO3(g) ,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(g) ,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L | D.SO3为0.4mol/L |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
可逆反应: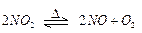 在体积一定的密闭容器中反应,达到平衡状态的标志是
在体积一定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
在容积固定的4L密闭容器中进行可逆反X(g)+2Y(g) 2Z(g),并达到平衡,在此过程中以Y的浓度改变表示的反应速率V(正)、V(逆)与时间t的关系如下图。图中阴影部分的面积表示
2Z(g),并达到平衡,在此过程中以Y的浓度改变表示的反应速率V(正)、V(逆)与时间t的关系如下图。图中阴影部分的面积表示
| A.X的浓度的减少 | B.Y的物质的量的减少 |
| C.Z的浓度的增加 | D.X的物质的量的减少 |