海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产。若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2─→Cu2S+2FeS+S…………………………… ①
2Cu2S+3O2=2Cu2O+2SO2………………………………… ②
Cu2O+FeS─→Cu2S+FeO……………………………… ③
2FeS+3O2+SiO2─→2FeO·SiO2+2SO2………………… ④
2FeO+SiO2─→2FeO·SiO2……………………………… ⑤
Cu2S+2Cu2O─→6Cu +SO2 ……………………………… ⑥
下列有关说法不正确的是
| A.上述反应均属于氧化还原反应 | B.该厂可同时建硫酸厂和炼铁厂 |
| C.该厂的原料除富铜矿外,还需空气和硅石 | D.反应④转移12e- |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
下列说法正确的是( )
| A.pH=12的NaOH溶液中,c(H+)=10-12 mol·L-1,稀释为原体积的10倍后c(H+)=mol·L-1=10-13mol·L-1 |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液因生成的CH3COONa水解,pH>7 |
| C.pH=3的HA酸溶液中c(H+)=10-3 mol·L-1,稀释为原体积的10倍后pH≤4 |
| D.pH=11和pH=13的NaOH溶液等体积混合后,溶液中的c(H+)=mol·L-1 |
今有室温下四种溶液,有关叙述不正确的是( )
| ① |
② |
③ |
④ |
|
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 |
| B.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11 ∶9 |
下列说法中正确的是( )
| A.在Na3PO4溶液中,c(Na+)是c(PO43-)的3倍 |
| B.pH为3的盐酸中,其c(H+)是pH为1的盐酸中c(H+)的3倍 |
| C.0.1 mol·L-1KOH溶液和0.1 mol·L-1氨水中,其c(OH-)相等 |
| D.在25℃时,无论是酸性、碱性还是中性的稀溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 |
通过对下图的观察,有以下几种叙述,其中不正确的是( )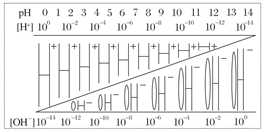
| A.该温度下,不论何种水溶液中c(H+)、c(OH-)乘积相等,即水的离子积是一个常数 |
| B.若醋酸钠溶液中c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-) |
| C.如果定义pOH=-lg c(OH-)时,则该温度下某水溶液中的pOH和pH之和等于14 |
| D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大 |