关于右图所示的原电池,下列说法正确的是
| A.电子从锌电极通过检流计流向铜电极 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.锌电极发生还原反应,铜电极发生氧化反应 |
| D.铜电极上发生的电极反应是2H++e-→H2↑ |
乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4 2H++C2O 2H++C2O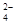 |
| B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂 |
| C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得 |
| D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O |
下列实验能获得成功的是()
| A.苯、溴水、铁粉混合制成溴苯 | B.加浓溴水,然后过滤可除去苯中少量苯酚 |
| C.用溴水可鉴别苯、CCl4、苯乙烯 | D.用硝酸银溶液直接检验溴乙烷中的溴元素 |
C9H18O2的有机物甲,可以在酸性条件下水解生成相对分子质量相同的两种有机物乙和丙,丙的催化氧化产物不能发生银镜反应。则C9H18O2的结构有()种
| A.3 | B.6 | C.8 | D.16 |
有关纯碱的工业生产中,下列说法正确的是()
| A.索尔维制碱法中氯化钠的利用率比侯氏制碱法高 |
| B.索尔维制碱法中的氨气和二氧化碳均来自合成氨工厂 |
| C.侯氏制碱法中能提高氯化钠的利用率并得到副产品氯化铵 |
| D.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
25℃某气态烃与氧气混合,在密闭容器中点燃爆炸后又恢复到25℃,此时容器内的压强为原来的一半,再经氢氧化钠溶液处理,容器内几乎为真空。该烃的分子式可能为()
| A.C2H6 | B.C2H4 | C.C3H6 | D.C3H4 |