设NA表示阿伏加德罗常数,下列说法不正确的是
| A.常温、常压下,22.4升N2所含的分子数小于NA个 |
| B.Na2O2与H2O反应生成11.2 L O2(标准状况),反应中转移的电子数为2×6.02×1023 |
C.32 g S8( )单质中含有的S—S键个数为6.02×1023 )单质中含有的S—S键个数为6.02×1023 |
| D.标准状况下,2.24L乙烷中含有的非极性键数约为0.7×6.02×1023 |
下列物质属于同系物的是()
| A.CH3CH2CH2OH与CH3CH2OCH3 |
B. 与 与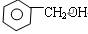 |
| C.CH3COOH与HCOOCH2 CH3 |
| D.CH3CH2CH2CHO与(CH3)2CHCH2CHO |
有机物分子中基团间的相互影响会导致化学性质的不同。下列叙述不能说明上述观点的是()
| A.乙烯可发生加成反应,而乙烷不能 |
| B.甲苯可以是高锰酸钾溶液退色,而乙烷不能 |
| C.甲苯与硝酸作用可得到2,4,6-三硝基甲苯,而苯与硝酸作用得到硝基苯 |
| D.苯酚能与NaOH溶液反应,而乙醇不能 |
与氢气完全加成后,不可能生成2,2,3-三甲基戊烷的烃是()
| A.CH2=C(CH2CH3)C (CH3)3 | B.CH2=C(CH3)C(CH3)2CH2CH3 |
| C.HC≡CCH(CH3)C(CH3)3 | D.(CH3)3CC(CH3)=CHCH3 |
下列有机物的命名正确的是()
A.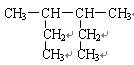 3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 |
| B. (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 |
C.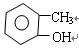 邻甲基苯酚 邻甲基苯酚 |
D.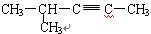 2-甲基-3-戊炔 2-甲基-3-戊炔 |
下列物质属于纯净物的是()
| A.酚醛树脂 | B.福尔马林 | C.葡萄糖 | D.纤维素 |