一种常见的胃药吗丁啉,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是( )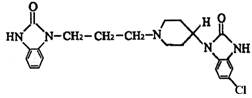
| A.该物质的分子式为C22H25ClN5O2 | B.该物质具有碱性,能与酸反应 |
| C.该物质可以发生水解反应 | D.该物质能发生取代反应和加成反应 |
Cu2O 是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应为:2Cu+H2O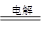 Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极发生的电极反应为Cu—eˉ= Cu+ |
| D.当有0.2mol电子转移时,有0.1mol Cu2O生成 |
下图是部分短周期主族元素原子半径与原子序数的关系图,下列说法正确的是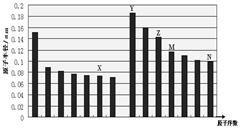
| A.最高价含氧酸的酸性:M>N |
| B.离子半径:X<Y |
| C.X和Y形成的化合物中一定含有含离子键 |
| D.化合物MX2能与碱反应,不能与任何酸反应 |
我国稀土资源丰富。下列有关稀土元素144 62Sm与150 62Sm的说法正确的是()
| A.144 62Sm与150 62Sm互为同位素 | B.144 62Sm与150 62Sm 的质量数相同 |
| C.144 62Sm与150 62Sm是同一种核素 | D.144 62Sm与150 62Sm的核外电子数和中子数均为62 |
设nA 为阿伏加德罗常数的数值 ,下列说法正确的是(相对原子质量:O-16)
| A.常温下,8gO2和O3的混合气体中含有4nA个电子 |
| B.1molFe2+与足量的H2O2溶液反应,转移2nA个电子 |
| C.1 L 0.1 mol ·L-1NaHCO3液含有0.1nA个HCO3- |
| D.常温常压下,22.4L的NO2 和CO2混合气体含有2 nA个氧原子 |
氯气是一种重要的工业原料。工业上利用反应在3Cl2+8NH3=N2+6NH4Cl检查氯气管道是否漏气。下列说法正确的是
| A.若管道漏气遇氨就会产生白雾 | B.该反应利用了氨气的还原性 |
| C.该反应属于复分解反应 | D.生成6molNH4Cl有18mol电子转移 |