化学实验是研究物质性质的基础。下列有关实验操作或测量数据合理的是:
| A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数 |
| B.用干燥的pH试纸测定浓硫酸的pH |
| C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液 |
| D.KMnO4溶液应装在碱式滴定管中 |
右图为一原电池的结构示意图,下列说法中,错误的是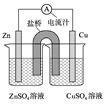
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能
| A.⑤ | B.①③⑤ | C.③⑤ | D.①②④ |
热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示
CO(g)+H2(g);△H =+131.3kJ/mol表示
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量 |
| C.1 mol C(S)和1 mol H2O(g)的能量总和大于1mol H2(g)和1mol CO(g)的能量 |
| D.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是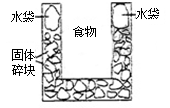
| A.硝酸铵 | B.生石灰 | C.氯化镁 | D.食盐 |
近年来,多地公共汽车大部分采用天然气或燃料电池作为动力,其主要目的是
| A.减少对大气的污染 | B.降低成本 |
| C.防止石油短缺 | D.加大发动机的动力 |