下列说法中,正确的是:
| A.0.1 mol·L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.室温下,某溶液中由水电离的出H+浓度为10-amol/L,a<7时,溶液的pH为a或14 -a |
某无色气体可能含有HCl、 HBr 、SO2、CO2中的一种或几种。将气体通入到适量氯水中,恰好完全反应,不再剩余气体。将所得的无色溶液分装在两个试管中,分别加入酸化的AgNO3溶液和酸化的BaCl2溶液,均产生白色沉淀。则下列判断正确的是()
| A.原气体中一定有SO2 ,一定无HBr | B.原气体中可能有SO2 |
| C.原气体中一定有HCl | D.不能确定有无HCl,但一定无CO2 |
下列有“国防金属”美誉之称的是()
| A.铁 | B.金 | C.铝 | D.镁 |
以NA表示阿伏加德罗常数,下列说法中正确的是()
| A.常温常压下,20 g D2O中含有的原子总数为3NA |
| B.3 mol KClO3中含有的氯离子总数为3NA |
| C.常温常压下,33.6 L O2中含有的原子数为3NA |
| D.56 g铁粉与足量硫粉反应,失电子数为3NA |
为测定气球内的气体成分,有学生用超薄材料的气球按下图装置进行实验。开始时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内可能的气体是()
(相对原子质量:H 1 C 12 O 16 Cl 35.5)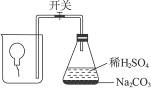
| A.氧气 | B.氢气 | C.甲烷 | D.氯气 |
某种单质硫的分子由x个硫原子构成。取n mol这种硫的单质,在足量氧气中完全燃烧生成8n mol SO2,关于这种单质的结论不正确的是( )
| A.化学式为S8 |
| B.相对分子质量为256 |
| C.1 mol该物质的质量为256 g |
| D.1 mol这种单质完全燃烧需1 mol氧气 |