在一定条件下,已达平衡的可逆反应:2A(g)+B(g) 2C(g),下列说法中正确的是:
2C(g),下列说法中正确的是:
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=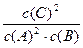 |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
某硫酸铝溶液中含 Al3+ ag ,则溶液中 SO42-的物质的量为()
A. mol mol |
B.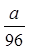 mol mol |
C.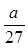 mol mol |
D.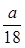 mol mol |
下列实验过程中出现的异常情况,其可能原因分析错误的是()
| 选项 |
异常情况 |
可能原因分析 |
| A |
蒸发结晶:蒸发皿破裂 |
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部 |
| B |
分液:分液漏斗中的液体难以滴下 |
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐 |
| C |
蒸馏:冷凝管破裂 |
冷凝管没有通水或先加热后通水 |
| D |
萃取:液体静置不分层 |
加入萃取剂的量较多 |
下列物质的分离方法不正确的是()
| A.用酒精萃取碘水中的碘 | B.用蒸馏的方法将自来水制成蒸馏水 |
| C.用淘洗的方法从沙里淘金 | D.用过滤的方法除去食盐水中的泥沙 |
下列说法中正确的是(NA表示阿伏伽德罗常数)
| A.28g N2所含有的原子数为NA |
| B.1.8g的NH4+离子中含有电子数11NA |
| C.22.4LCH4的质量与NA个甲烷分子的质量之和相等 |
| D.标准状况下,22.4LCH4和O2的混合气体所含有的分子数为NA |
下列溶液中的氯离子浓度与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是()
| A.150 mL 1 mol·L-1的NaCl | B.75 mL 2 mol·L-1的NH4Cl |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |