工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)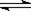 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
| A.SO2的转化率为30% |
| B.反应共放出了196.6 kJ的热量 |
| C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1 |
| D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同 |
短周期主族元素X、Y、Z、W在元素周期表中的位置关系如图,下列推论合理的是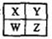
| A.若Z的核电荷数是Y的两倍,则X为碳元素 |
| B.若W的核电荷数是Y的两倍,则X是氮元素 |
| C.原子半径:Z>Y>X |
| D.最简单氢化物的稳定性:Y>X>W |
实验室某些物质的制备装置如图所示(省略夹持装置和净化装置),仅用此装置和表中提供的物质完成相关实验,最合理的是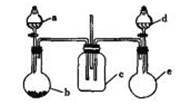
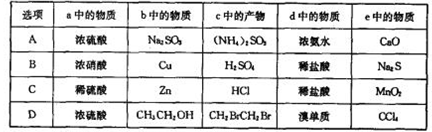
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
| A.充电时电极a为电源的负极 |
| B.放电时负极的电极反应式为 Zn+2e-=Zn2+ |
| C.放电时左侧的电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止 Br2和Zn 直接发生反应 |
在酸性介质中,向MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生如下离子反应: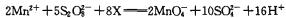 ,下列说法正确的是:
,下列说法正确的是:
| A.X是 H2O |
| B.还原性:SO42->Mn2+ |
| C.该反应中酸性介质可以为盐酸 |
| D.每生成0.1 molSO42-转移电子0.05 mol |
柠檬烯醇是一种食用香精,其结构简式如图所示。下列有关柠檬烯醇的说法正确的是
| A.能与氢氧化钠溶液发生中和反应 |
| B.能发生加成反应和取代反应 |
| C.不能使酸性高锰酸钾溶液褪色 |
D.与对丙基苯甲醇 互为同分异构体 互为同分异构体 |