下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-) =c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
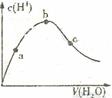
| D.向冰醋酸中逐渐加水,有如图变化:a、b、c三点中水的电离程度最大的是b点 |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
| A.0.25molNa2O2中含有的阴离子数为0.5×6.02×1023 |
| B.7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 |
| C.2.24LCH4中含有的原子数为0.5×6.02×1023 |
| D.250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023 |
对下列事实的解释正确的是
| A.葡萄糖能够发生银镜反应,说明葡萄糖是单糖 |
| B.浓硝酸沾到皮肤上,皮肤颜色变黄,说明浓硝酸不稳定 |
| C.乙醇与金属钠反应速率比水慢,说明乙醇比水难电离 |
| D.小苏打与盐酸反应产生气泡的速率比纯碱快,说明HCO3—更易结合H+ |
某同学进行中和滴定实验,并绘制出如图所示的滴定曲线。下列有关该实验的说法正确的是
| A.锥形瓶中盛有NaOH溶液,指示剂为酚酞 |
| B.滴定管使用前先用待测液润洗,再用蒸馏水润洗 |
| C.滴定时,应时刻注视滴定管中液面的变化 |
| D.滴定终点附近,测试和记录pH的间隔要小 |
北京奥运火炬的外壳主要采用高品质的铝合金材料制造,燃烧系统内装环保型燃料——丙烷。下列有关说法中正确的是
| A.丙烷是石油裂解气的主要成分 | B.丙烷燃烧时的耗氧量比等体积的其他烷烃少 |
| C.燃料燃烧时主要是将热能转化为光能 | D.铝合金制作的火炬质量轻、不易腐蚀 |
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,该燃料电池是以甲醇为燃料,氧气为氧化剂,电解质可以是质子交换膜(可传导氢离子),也可以是固体氧化物(可传导氧离子),甲醇和氧气分别在多孔金属电极上发生反应,从而将化学能直接转化为电能。下列叙述中错误的是
A.电池放电时,甲醇在负极发生氧化反应
B.以固体氧化物为电解质的电池放电时,氧离子由负极移向正极
C.以质子交换膜为电解质的电池放电时,正极的反应为:O2+4H++4e—2H2O
D.电池的总反应是:2CH3OH+3O22CO2+4H2O