控制适合的条件,将反应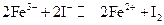 设计成如右图所示的原电池。下列判断不正确的是( )
设计成如右图所示的原电池。下列判断不正确的是( )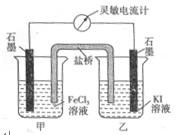
| A.反应开始时,乙中石墨电极上发生氧化反应 |
B.反应开始时,甲中石墨电极上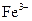 被还原 被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
D.电流计读数为零后,在甲中溶入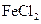 固体,乙中的石墨电极为负极 固体,乙中的石墨电极为负极 |
3.2gCu与过量的8mol/L30mLHNO3反应,硝酸的还原产物为NO2和NO,反应结束后测得溶液中n(H+)为amol,则溶液中所含n(NO3-)为


| A.amol | B.(0.1+a)mol | C.(0.05+a)mol | D.(0.2+a)mol |
NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.5.6 g铁与足量硫的反应中,铁失去的电子数为0.3NA |
| B.标准状况下,22.4 L SO3所含原子数为4 NA |
| C.1.8g的NH4+离子中含有的电子数为NA |
| D.20 g D2O中所含的中子数为8 NA、 |
某元素原子的原子核内质子数为m,中子数为n,则下列论述正确的是
| A.不能由此确定该元素的相对原子质量 |
| B.这种元素的相对原子质量为(m + n) |
| C.若碳原子的质量为W g,此原子的质量为(m + n)W g |
| D.核内中子的总质量小于质子的总质量 |
将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜,在这两种情况下均保持不变的是


| A.硫酸铜的溶解度 | B.溶液的质量 |
| C.溶液中溶质的质量分数 | D.溶液中Cu 的数目 的数目 |
巳知某溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能大量存在的离子组是
| A.Al3+、CH3COO—、Cl— | B.Mg2+、Ba2+、Br— |
| C.Mg2+、Cl—、I— | D.Na+、NH4+、Cl— |