(16分) 现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但都有一种相同的化合价,C的单质常用于太阳能电池。它们的一些物理量如下:
| 元素 |
A |
B |
C |
D |
| 原子半径/nm |
0.102 |
0.077 |
0.117 |
0.075 |
| 单质的沸点/℃ |
444.6 |
4827 |
2355 |
–195.8 |
(1)A的元素符号为__________,D元素在周期表第_______周期、第_______族。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是____________________。
(3)含D的两种常见化合物发生化合反应可生成一种离子化合物,该离子化合物撞击时可分解为两种非金属单质和一种化合物,其中一种为D单质,写出该分解反应的化学方程式____________________________________________________________________。
(4)A、B、C、D均能分别形成含18个电子的氢化物,这些氢化物的分子式分别是________________________________________________。
(5)B、D及氢元素中的两种或三种可形成多种含14个电子的化合物,其中空间构型为直线型的是_______________________和_______________________(写结构式)。
已知: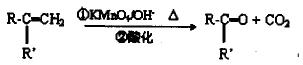
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3molCO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成含甲基的六元环状酯类化合物。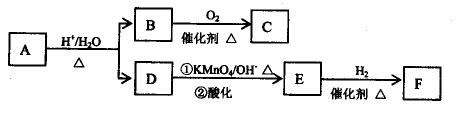
请回答:
(1)1molB与足量的金属钠反应产生的22.4L(标准状况)H2。B中所含官能团的名称是。B与C的相对分子质量之差为4,B→C的化学方程式是。
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是。
(3)F可发生多种类种类型的反应:
①两分子F反应生成的六元环状酯类化合物的结构简式是。
②由F可生成使 Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是。
③F在一定条件下发生缩聚反应的化学方程式是。
(4)A的结构简式是。
已知A、B、C、D、E、F都是周期表中前四周期的元素。它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出C原子的价层电子排布图,F位于周期表区。
(2)A、B、C的第一电离能由小到大的顺序为。(写元素符号)
(3)F和质子数为25的M的部分电离能数据列于下表
| 元素 |
M |
F |
|
| 电离能(kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是。
(4)晶胞中F原子的配位数为,若F原子的半径为rcm,则F晶体的密度为(用含r的表达式表示),该晶胞中原子空间利用率为。
(5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
比任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因。
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
| 物质 |
FeSO4 |
H2SO4 |
Ag2SO4 |
Al2(SO4)2 |
污泥 |
| 质量分数/(%) |
15.0 |
7.0 |
0.40 |
0.34 |
5.0 |
表二 FeSO4和Al2(SO4)3在水中的溶解度
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| FeSO4溶液度(g) |
15.6 |
20.5 |
26.5 |
32.9 |
40.2 |
48.6 |
| Al2(SO4)3溶解度(g) |
31.2 |
33.5 |
36.4 |
40.4 |
45.7 |
52.2 |
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③,目的是使Ag+全部还原为金属Ag;
④,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是。
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。右图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液。请回答下列问题: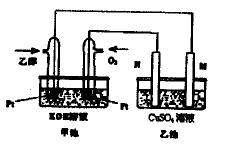
(1)N的电极反应式为。
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气L(标准状况下)。
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇g。
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)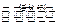 CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g) CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=,
②条件相同时,反应I与反应II相比,转化程度更大的是。
③在一定压强下,测得反应I的实验数据如下表: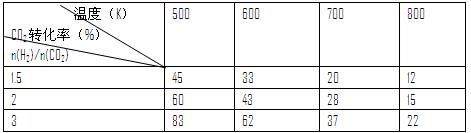
根据表中数据分析:
温度升高,K值(填“增大”、“减小”或“不变”),提高氢碳比。n(H2)/n(CO2),对生成乙醇(填“不利”或“有利”)。
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,已知该有机物含氧27.3%。C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。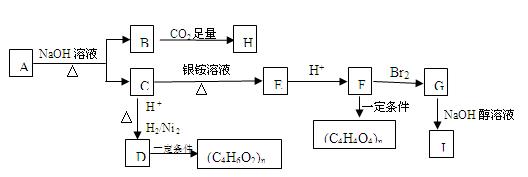
(1)A的分子式为。A→B+C的反应方程式为。
(2)写出由B生成H的反应方程式为。
(3)与D具有相同官能团的同分异构体有几种:。
(4)G的结构简式为,由G到J的反应类型为。