在相同条件下,有下列三个热化学方程式:
(1)H2(g)+1/2O2(g)=H2O(g);△H=-Q1
(2)2H2(g)+O2(g)=2H2O(1);△H=-Q2
(3)2H2(g)+O2(g)=2H2O(g);△H=-Q3
则Q1、Q2、Q3的关系正确的是
| A.Q1=Q3<Q2 | B.Q2>Q3>Q1 | C.Q3>Q2>Q1 | D.Q1=Q2=Q3 |
在N2+3H2 2NH3 △H<0的平衡体系中,当分离出NH3时,下列说法正确的是()
2NH3 △H<0的平衡体系中,当分离出NH3时,下列说法正确的是()
| A.反应速率增大 | B.平衡向逆反应方向移动 |
| C.平衡体系中NH3的含量增大 | D.N2的转化率增大 |
下列有关合成氨工业的叙述中,可用勒夏特列原理解释的是()
| A.使用铁触媒,有利于合成氨 |
| B.高压比低压条件更有利于合成氨的反应 |
| C.500℃左右的温度比室温更有利于合成氨的反应 |
| D.及时移走NH3 |
在固定体积的密闭容器中进行如下反应N2+3H2 2NH3 △H<0:,若将平衡体系中各物质的浓度都增大到原来的2倍,则产生的结果是()
2NH3 △H<0:,若将平衡体系中各物质的浓度都增大到原来的2倍,则产生的结果是()
①平衡不移动;②平衡右移;③平衡左移;④NH3的百分含量增加;⑤υ(正)、υ(逆)均增大。
| A.①⑤ | B.①②⑤ | C.③⑤ | D.②④⑤ |
NH3氧化制硝酸时,在吸收塔里发生如下反应:3NO2+3H2O  2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是()
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是()
| A.降温 | B.升温 | C.减压 | D.增压 |
能使合成氨反应:N2+3H2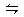 2NH3 △H<0,进行程度增大的是()
2NH3 △H<0,进行程度增大的是()
| A.升高温度 | B.降低压强 |
| C.使用催化剂 | D.及时分离出NH3 |