A 、B 、C 、D 、E 、F、G为原子序数依次增大的元素,其中前六种属于短周期元素。已知B 、C 、F 三种原子的最外层共有11 个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应并且生成盐和水。请完成下列问题:
(1)只根据以上条件一定能判断出的元素的及符合条件的离子的符号填写在下表空格处
| 编号 |
A |
B |
C |
D |
E |
F |
G |
半径最小的离子 |
| 符号 |
|
|
|
|
|
|
|
|
 (2)写出B、C 的最高价氧化物对应的水化物间反
(2)写出B、C 的最高价氧化物对应的水化物间反
应的离子方程式____________
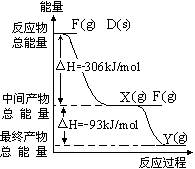
(3)己知D的单质在F单质中燃烧可生成X、Y两
种化合物并产生白色烟雾,写出X、Y中各原子
最外层均满足8 电子结构的分子的电子式___。
D、F的单质反应过程和能量关系如图所示(图
中的△H表示生成1mol产物的数据),写出指定
条件下两种单质作用生成Y时的热化学方程式
_______________________。
(4) G的单质是目前用途最广泛的一种金属材料,但在使用中受环境影响易被腐蚀,试写出发生腐蚀时的电极反应式_________________________________________。
(5)A与E能形成两种常见的化合物,这两种化合物中属于非极性分子的物质化学式_______
A、B、C、D、E、F是原子序数依次递增的前四周期元素。其中A与D同主族、C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2∶3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液变红。据此回答下列问题:
(1)F元素形成的高价基态离子的核外电子排布式为;C、D、E三元素原子均能形成简单离子,其离子半径大小顺序为(用离子符号表示);
(2)A与C形成的10电子分子中含的化学键类型为(填σ键或π键),分子中心原子的轨道杂化类型为,其化合物晶体类型为;化合物A2C和A2E中,沸点较高的是(填分子式);
(3)向含1 mol A2E的水溶液中加入等物质的量的D2C2,有黄色沉淀生成,写出离子方程式:
(4)常温常压下,有23 g液态化合物B2A6C与足量的C的单质充分反应,生成BC2气体和A2C液体,同时放出683.5 kJ的热量,该反应的热化学方程式为:。
碳酸锂广泛应用与陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下: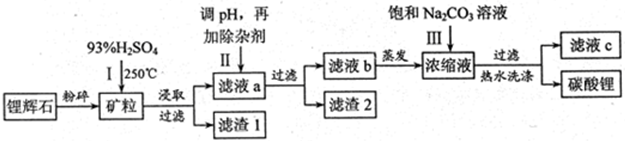
已知:①2LiAlSi2O6+H2SO4(浓)  Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如右表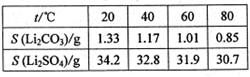
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、Mg2+ 、Ca2+、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的pH到6.0~6.5,此时沉淀的杂质离子有。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生反应的离子方程式有。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是。
(5)从滤液c中可回收的主要物质是。
CO2的固定和利用在降低温室气体排放中具有重要作用,从CO2加氢合成甲醇不仅可以有效缓解减排压力,还是其综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应CO2+3H2 CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题:
CH3OH+H2O,测得甲醇的理论产率与反应温度、压强的关系如图所示。请回答下列问题: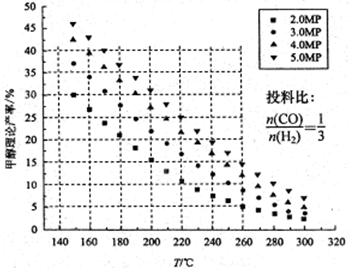
(1)提高甲醇产率的措施是。
(2)分析图中数据可知,在220 ℃、5MPa时,CO2的转化率为,再将温度降低至
140℃,压强减小至2MPa,化学反应速率将(填“增大、减小 或 不变“ 下同),CO2的转化率将。
(3)200℃时,将0.100molCO2和0.275molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K=。(要求写出算式和计算结果)
(4)已知已知:CO的燃烧热△H=-283.0KJ/mol、2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol、
CO(g)+2H2(g)=CH3OH(g)△H=-90.1KJ/mol,写出CO2与H2合成甲醇的热化学方程式。
已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大,X基态原子的核外电子分布在3 个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子,请回答下列问题。
(1)微粒XZ32-的中心原子杂化类型为化合物YW3的空间构型为。
(2)R基态原子的电子排布式为,元素X、Y、Z的第一电离能由大到小的顺序为
(用元素符号表示)。
(3)一种新型导体晶体的晶胞如右图所示,则该晶体的化学式为,其中一个Q原子紧邻个R原子。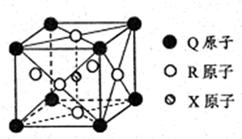
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是弱酸HXY分子中存在的σ键与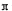 键的数目之比为。
键的数目之比为。
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为: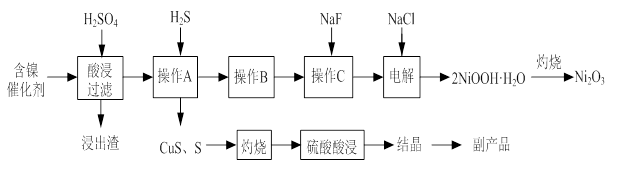
图Ⅰ图Ⅱ
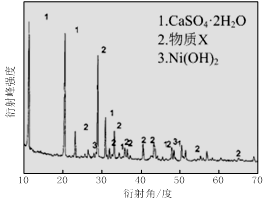
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为______mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为。