(1)具有支链的化合物A的分子式为C4H6O2,A可以使Br2的四氯化碳溶液褪色。1molA和1molNaHCO3能完全反应,则A的结构简式是。
写出与A具有相同官能团的A的所有同分异构体的结构简式______________。
(2)化合物B含有C、H、O三种元素,分子量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在催化剂Cu的作用下被氧化成C,C能发生银镜反应,则B的结构简式是___________。
(3)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是_______________________________________________________________________________
(每一小空2分共12分)下面是一个合成反应的流程图:
(1)、写出下列物质的结构简式
| A.、 | B.、 |
| C.、 | D. . |
(2)写出下列化学反应的方程式:
③;⑤、;
某学生查阅资料得知溴乙烷的物理性质与制取方法如下表:
联想到所学溴苯的制取,他设了制取溴苯和溴乙烷的装置I,主要实验步骤如下:
①检查气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓硫酸的混合液至恰好于进气导管口。
③将A装置中的纯铁丝向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min.请填写下列空白: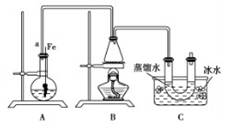
(1)A中发生反应的方程式
(2)装置长导管a的作用是
(3)C装置中的U形管内用蒸馏水封住管底的作用是
(4)反应完毕后,U形管内的现象是分离出溴乙烷时所用的最主要的仪器名称是(只填一种)
为了确定CH3COOH ,OH及H2CO3的酸性强弱,有人设计一个简单的一次性完成实验的装置图如右所示:(每空2分共8分)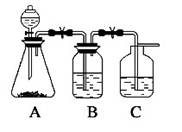
(1)若锥形瓶中装有一易溶于水的正盐固体,则A中发生反应的离子方程式为
(2)装置B中盛放的试剂是,它的作用是
(3)实验中观察到C中出现的主要现象是
.
(共9分每小题3分)有某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为_______;
(2)A中的碳原子是否都处于同一平面?_______(填“是”或者“不是”);A分子是否存在顺反异构体_______(填“是”或者“不是”);
(3)已知A,B,C有如下转化关系,
则反应②的化学方程式为;反应的类型是________。
(共8分,每小题只填写一种,该空不给分)试写出符合下列条件的有机物的结构简式:
(1)完全燃烧后生成CO2和水蒸气的体积比为2:1的2种有机物的结构简式:
,
(2)完全燃烧后生成CO2和水蒸气的体积比为1:2的2种有机物的结构简式:
,
(3)相对分子质量不等且不论以何种比例混合,只要混合物的总质量一定,完全燃烧后生成水的总质量也不改变的1组有机物质是和。
(4)相对分子质量不等,只要总质量一定,无论按什么比例混合,完全燃烧后生成CO2和水的质量也是恒定的有机物的结构简式是和。