某学生做乙醛的还原实验,量取5 mL 1 mol·L-1的CuSO4溶液加入到盛0.5 mol·L-1 NaOH溶液4 mL的试管中混合,然后滴加0.5 mL 4%乙醛溶液,加热至沸,未观察到红色沉淀,分析原因可能是( )
| A.乙醛量不够 | B.烧碱量不够 | C.硫酸铜不够 | D.加热时间短 |
下列有关沉淀溶解平衡的说法中,正确的是()
A. Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大
C.在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
D.向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀
室温下,若溶液中由水电离产生的c(OH-)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是()
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、NO3- |
| C.K+、Na+、Cl-、AlO2- | D.K+、NH4+、SO42-、NO3- |
反应2A(g)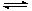 2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是()
2B(g)+C(g) △H>0,要使逆反应速率增大,A的浓度减小(只改变一个条件),应采取的措施是()
| A.减压 | B.升温 | C.加入合适的催化剂 | D.增大B的浓度 |
升高温度,下列数据不一定增大的是()
| A.化学反应速率v | B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K | D.水的离子积常数KW |
已知某温度下,K(HCN)= 6.2×10-10 mol·L-1、K(HF)= 6.8×10-4 mol·L-1、K(CH3COOH)= 1.8×10-5 mol·L-1、、K(HNO2)= 6.4×10-6mol·L-1。物质的量浓度均为0.1 mol·L-1的下列溶液中,pH最小的是()
| A.NaCN | B.NaF | C.CH3COONa | D.NaNO2 |