用一氧化碳和氢气在443—473 K温度下,并用钴作催化剂时,可以反应生成
n=5—8的烷烃,这是人工合成汽油的方法之一。
(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式_____________________。
(2)如果向密闭的合成塔里通入恰好能完全反应的CO和H2,当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的2/5。通过计算说明这时有无汽油生成。
(3)要达到上述合成汽油的要求,CO和H2的体积比的取值范围是多少?
已知25℃时部分弱电解质的电离平衡常数数据如下表: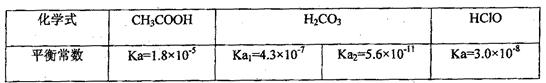
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClOd. NaHCO3;pH由小到大的排列顺序是(用字母表示)
NaHCO3;pH由小到大的排列顺序是(用字母表示)
(2)常温下,0.1mol·L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/c(H+) |
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数CH3COOH的电离平衡常数(填大于、小于或等于)
理由是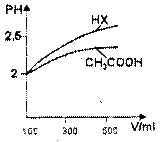
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)—c(Na+)=mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=
有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。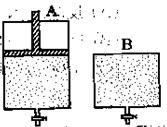
在保持400℃的条件下使之发生如下反应:2SO2+O2 2SO3。试填写下列空格:
2SO3。试填写下列空格:
(1)A容器达到平衡时所需的时间比B容器;(填“短”、“长”或“相等”)
平衡时A容器中SO2的转化率比B容器;(填“大”、“小”或“相等”)
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等物质的量的氩气,A容器中化学
平衡移动,B容器中化学平衡;(填“逆向”、“正向”或“不移动”)
(3)达到(1)所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容
器的混合气体中SO3的体积分数(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数。
在常温下,下列三种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4
请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是:
(用离子方程式表示)
(2)在上述三种溶液中,pH最小的是;c(NH4+)最小的是﹝填序号﹞
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在反应③中,生成的沉淀物质的化学式是。
(2)C是, E是(填化学式)。
(3)A与E反应的离子方程式是。
将24.4 g Na OH固体溶于水配成100m L溶液,其密度为1.219 g / mL
(1)该溶液中NaOH的物质的量浓度为。
(2)该溶液中NaOH的质量分数为。
(3)从溶液中取出10ml,其中NaOH的物质的量浓度为,NaOH的质量分数为,溶液的密度为,含NaOH的质量为,含NaOH的物质的量为。
(4)将取出的10mL溶液加水稀释到100 mL,稀释后溶液NaOH的物质的量浓度为
。