对于反应3Cl2+6NaOH ==5NaCl+NaClO3+3H2O,以下叙述正确的是()
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.被氧化的Cl原子和被还原的Cl原子的物质的量的比为5∶1 |
| C.Cl2既是氧化剂又是还原剂 |
| D.每生成1mol的NaClO3转移6mol的电子 |
下列反应的离子方程式书写正确的是()
| A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.氯气通入溴化钾溶液:Cl2+2Br-=Br2+2Cl- |
| C.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D.稀硫酸和氢氧化铜反应:H++OH-=H2O |
下列各组溶液中离子,能在溶液中大量共存的是()
| A.H+、Ca2+、NO3-、CO32- | B.K+、Na+、Br-、NO3- |
| C.Ag+、Na+、Cl-、K+ | D.NH4+、Cl—、OH¯、SO42— |
海藻中含有丰富的、以离子形式存在的碘元素.下图是实验室从海藻里提取碘的流程的一部分。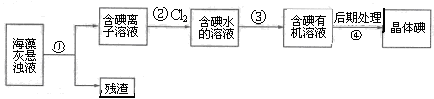
下列判断正确的是()
| A.步骤①、③的操作分别是过滤、萃取分液 |
| B.可用淀粉溶液检验步骤②的反应是否进行完全 |
| C.步骤③中加入的有机溶剂是乙醇 |
| D.步骤④的操作是过滤 |
下列有关氯水的叙述,正确的是()
| A.新制氯水只含有氯分子和次氯酸分子; |
| B.新制氯水可使紫色石蕊试液先变红后褪色; |
| C.氯水光照时有气泡逸出,该气体的主要成分是氯气; |
| D.氯水放置数天后,其酸性逐渐减弱。 |