合成氨工业对国民经济和社会发展具有重要的意义。哈伯法合成氨需要在20~50MPa的高压和500℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。最近英国俄勒冈大学的化学家使用了一种名为 trans一Fe(DMeOPrPE)2 的新催化剂,在常温下合成氨,反应方程式可表示为N2 +3H2 2NH3 . 有关说法正确的是
2NH3 . 有关说法正确的是
| A.哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C.新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D.新催化剂降低了反应所需要的能量,提高了活化分子百分数 |
如果你家里的食用花生油不小心混入了部分水,利用你所学的知识,采用最简便的分离方法是
下列事实与胶体知识有关的是
①用盐卤点豆腐;②生产出果冻;③用明矾净水;④河海交汇处可沉积成沙洲;
⑤初冬凌晨的迷雾的形成
| A.①②③ | B.②③④ | C.①③⑤ | D.全部都是 |
丙烷的分子结构可简写成键线式结构 ,有机物A的键线式结构为
,有机物A的键线式结构为 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是
A、有机物A的一氯取代物只有4种
B、用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C、有机物A的分子式为C8H18
D、B的结构可能有3种,其中一种名称为3,4,4-三甲基-2-戊烯
已知化合物B3N3H6(硼氮苯)与C6H6(苯)分子结构相似,如图:
则硼氮苯的二氯取代物B3N3H4Cl2的同分异构体的数目为
| A.2 | B.3 | C.4 | D.6 |
下列反应属于取代反应的是
①CH3CH===CH2+Br2 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH CH2===CH2↑+H2O
CH2===CH2↑+H2O
③CH3COOH+CH3CH2OH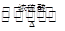 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3 C6H5NO2+H2O
C6H5NO2+H2O
⑤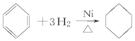
⑥2CH3CH2OH+O2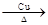 2CH3CHO+2H2O
2CH3CHO+2H2O
⑦纤维素最终水解生成葡萄糖
⑧油脂的皂化反应
⑨nCH2===CH2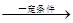 CH2—CH2
CH2—CH2
| A.③④⑦⑧ | B.①②③④ | C.⑤⑥⑦⑧ | D.③④⑥⑦ |