(1)在实验过程中水的电离程度的变化趋势是先_______后________;(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化,如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1molN—H键所需的能量(kJ)是
| A.194 | B.391 |
| C.516 | D.658 |
可逆反应A+B(s) C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论可能正确的是
C达到平衡后,无论加压或降温,B的转化率都增大,则下列结论可能正确的是
A.A为气体,C为固体,正反应为放热反应
B.A为固体,C为气体,正反应为放热反应
C.A为气体,C为固体,正反应为吸热反应
D.A、C均为气体,正反应为吸热反应
某一元有机酸HA的溶液中,若未电离的HA分子个数与溶液中的离子个数比为a:b,则HA的电离度(即转化率)是
A.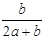 ×100% ×100% |
B.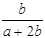 ×100% ×100% |
C.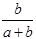 ×100% ×100% |
D.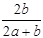 ×100% ×100% |
下列各组Na2S2O3溶液跟稀H2SO4反应的实验中,溶液中最先变浑浊的是
| 选项 |
反应 温度 |
反应物 |
H2O |
|||
| Na2S2O3 |
H2SO4 |
|||||
| t(℃) |
V(mL) |
c(mol×L-1) |
V(mL) |
c(mol×L-1) |
V(mL) |
|
| A |
10 |
5 |
0.1 |
10 |
0.1 |
10 |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
30 |
| C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
| D |
30 |
5 |
0.2 |
5 |
0.2 |
35 |
反应P(g)+Q(g) M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡不移动 | B.加入催化剂,M的产率增大 |
| C.增大c(P),P的转化率增大 | D.降低温度,Q的转化率增大 |