方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________ 另一电极所发生的电极反应为_____________________________ 方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
已知X、Y、Z、W(含同一元素)有如下所示转化关系,且X能与W发生反应生成一种易溶于水的盐,则X可能是( )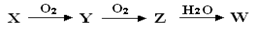
| A.N2 | B.NO2 | C.NH3 | D.NO |
能证明SO2具有漂白性的是( )
| A.品红溶液中通入SO2气体,溶液红色消失 |
| B.溴水中通入SO2气体后,溶液褪色 |
| C.滴入酚酞的NaOH溶液中通入SO2气体,红色消失 |
| D.酸性KMnO4溶液中通入SO2气体后,溶液褪色 |
将一定质量的Mg,Zn,Al混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),原混合物的质量可能是( )
| A.2g | B.4g | C.10g | D.12g |
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A.向NaHCO3固体中加入新制的氯水,有无色气泡产生(H+) |
| B.新制氯水使红色布条褪色(HCl) |
| C.将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) |
| D.向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,溶液呈红色(Cl2) |
硅及其化合物的应用范围很广。下列说法正确的是( )
| A.硅是人类将太阳能转换为电能的常用材料 |
| B.粗硅制备单晶硅不涉及氧化还原反应 |
| C.石英玻璃和餐桌上的瓷盘都是硅酸盐制品 |
| D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |