一、二级标准:4.00,三级标准:6.00 。一环保检测中心对采集的0.02m3(标况)某区域空气样品中所含CO的浓度进行测定,其方法和实验步骤如下:
①首先将空气样品通过盛有I2O5固体的加热管,反应生成CO2和I2(不考虑其他气体的反应);
②用30.0mL 5.00×10-5mol·L-1过量的硫代硫酸钠溶液完全吸收反应所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③ 将②反应后溶液取出1/2,放入锥形瓶中,加入几滴指示剂,用1.00×10-5mol·L-1的标准碘溶液进行滴定,滴定至终点,实验记录如下: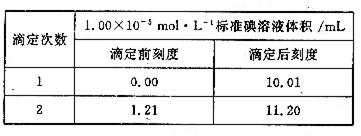
(1) 写出中反应的化学方程式:
(2) 计算该空气样品中CO的浓度,并说明符合几级标准。
(6分)某温度下有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示 。对三种蒸气测定结果是
。对三种蒸气测定结果是
(1)橙色蒸气密度折算到标准状况后是11.34g/L,则它的化学式是__________.
(2)红橙色蒸气的质量是相同状况时同体积空气的6.62倍,则它的化学式是__________.
( 3)无色蒸气对氢气的相对密度是64,则它的化学式是__________.
3)无色蒸气对氢气的相对密度是64,则它的化学式是__________.
(2分)相同质量的钠、镁、铝与过量的稀硫酸反应,在状况下产生氢气的质量比是 ,若过量的相同质量的钠、镁、铝与相同质量分数,相同质量的稀硫酸溶液反应,产生氢气最多的是 。
在 101 kPa时,1mol CH4完全燃烧生成CO2和液态H2O,放出 890 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
将6.5g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。
(2)所用盐酸中HCl的物质的量浓度。
在合成氨的生产中,将N2和H2按1:3的体积比充入合成塔,压强为20Mpa,从合成塔出来的气体中,氨气的体积分数为20%,若反应前后温度不变,试求:
(1)从合成塔出来的气体的压强是多少?
(2)平衡时,N2的转化率是多少?