设 NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
( )
 A.1L0.1mol·L-1乙酸溶液中H+数为0.1 NA
A.1L0.1mol·L-1乙酸溶液中H+数为0.1 NA B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA
C .标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
.标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA D.将0.1mol氯化铁溶于1L水中,所得溶液含有
D.将0.1mol氯化铁溶于1L水中,所得溶液含有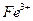 个数为0.1 NA
个数为0.1 NA
制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。 阴极:2H3O++2e-→H2↑+2H2O
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O—→H2SO4+H2SO5第二步水解H2SO5+H2O—→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( )
| A.0.5mol | B.1mol | C.1.5mol | D.2mol |
已知Co2O3在酸性溶液中被还原成Co2+,Co2O3、Cl2、FeCl2、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
| A.3Cl2 +6FeI2 =2FeCl3 +4FeI3 | B.Cl2 +FeI2=FeCl2 +I2 |
| C.Co2O3+6HCl=2CoCl2 +Cl2 +3H2O | D.2Fe3+ +2I— =2Fe2++I2 |
把铁、铜、FeCl3、FeCl2和CuCl2溶液混在一起,铁有剩余,则溶液中所含最多的阳离子是
| A.H+ |
| B.Cu2+ |
| C.Fe3+ |
| D.Fe2+ |
已知:C(s) + O2(g) = CO2 (g);ΔH = -393.5 kJ/ mol;H2(g) +  O2(g) =" 2" H2O(l);ΔH = -241.8 kJ/ mol;
O2(g) =" 2" H2O(l);ΔH = -241.8 kJ/ mol;
欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为()
| A.2:3.25 | B.12:3.25 | C.1:1 | D.393.5:241.8 |
| A.Fe粉与硫粉混合加热 |
| B.常温下将氢氧化钡晶体与氯化铵粉末混合反应 |
| C.将铁片投入到稀硝酸溶液中 |
| D.Al粉与NaOH溶液反应 |