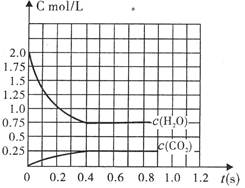

(1)请在图中画出c(H2)随时间t的变化曲线图;
(2)平衡时c(O2)平为 mol/L。
(3)欲计算出平衡时O2的浓度,除已知“H2O(g)
和CO”的物质的量外,至少需要知道平衡体
系中某两种气体的平衡浓度。这两种气体除
可以是H2O和CO2外还可以是 。
(4)在其它条件不变的情况下,若改为起始时在
容器中充入2molH2和2molCO2,则上述两反
应达到平衡时,c(O2)平= mol/L。
在100mL 0.6mol·L-1 AlCl3溶液中,滴加一定量的1.0mol·L-1 NaOH溶液,充分反应后得到3.9g白色沉淀,试计算加入NaOH溶液的体积为多少?
某抗酸药每片含有碳酸钙540mg,氢氧化镁180mg。
(1)写出该抗酸药发挥功效时的化学反应方程式。
(2)该药片中的碳酸钙和氢氧化镁哪种物质中和的胃酸(以盐酸计)多?
一定量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气重49.6克,当将其缓慢经过无水CaCl2时,CaCl2增重25.2克。则原混合气中CO2的质量为多少?
已知某人每日所需热量为12000kJ,每克糖类、蛋白质、油脂在人体内氧化所提供的热量分别为16.7kJ、16.7kJ、37.7kJ。又已知糖类、蛋白质、油脂对人体内所需热能所占的百分数分别为60%~70%、10%~15%、20%~25%。试判断该人每日摄入500g淀粉、lOOg蛋白质、60g油脂是否合乎平衡膳食要求。
某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08g和2.64g。试求该有机物的分子式。