(1)写出元素的名称:A ,C 。
(2)Y分子是 分子(填极性和非极性)。
(3)写出实现下列转化的化学反应方程式并标明电子转移的方向和数目:
C2+(BA)n→A2
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式:
常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是()
| A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L |
| B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.c(OH-)-c(HY)=c(H+)=1×10-9 mol/L |
| D.c(Na+)=c(Y-)+c(HY)="0.3" mol/L |
在实验室不能用玻璃试剂瓶盛放的试剂是()
| A.氢氟酸 | B.饱和碳酸钠溶液 | C.浓硫酸 | D.氢氧化钠溶液 |
甲苯和甘油组成的混合物,若检测出混合物中碳元素的质量分数为60%,那么氧元素的质量分数为()
| A.34.3% | B.31.3% | C.27.3% | D.33.3% |
H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42—的物质的量之比为()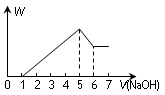
| A.1∶1∶1 | B.5∶3∶2 | C.2∶1∶5 | D.3∶2∶2 |
下列说法中合理的是()
| A.味精的主要成分为蛋白质,烧菜时可加入适量 |
| B.养鸭厂添加苏丹红制“红心鸭蛋”,可使鸭蛋色泽鲜艳、美观 |
| C.汽水中添加林丹、毒死蜱和七氯苯等药剂制“××可乐”,以增强口感和余味 |
| D.将废弃塑料热裂解处理,可以获得乙烯、丙烯等化工原料 |