按图4-7装置进行实验,并回答下列有关问题。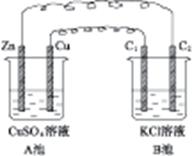
图4-7
(1)判断装置的名称:A池为 ,B池为 。
(2)锌为 极,电极反应式为 。铜为 极,电极反应式为 。石墨棒C1为 极,电极反应式为 。石墨棒C2为 极,电极反应式为 。
(3)当C2极上析出224 mL气体(标准状况)时,锌的质量变化了(“增加”或“减少”) g,CuSO4溶液的质量变化了(“增加”或“减少”) g。
MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是。(2)除铁发生的离子反应方程式为。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大=mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH=时锰、铬去除率最好
炔抑制剂的合成路线如下: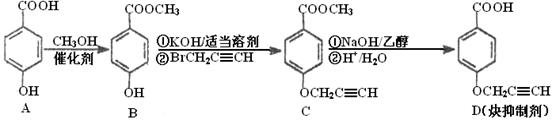 (1)化合物A核磁共振氢谱有________种峰。
(1)化合物A核磁共振氢谱有________种峰。
(2)化合物C中含氧官能团有___________、__________(填名称)。
(3)鉴别化合物B和C最适宜的试剂是________________。
(4)写出A—B的化学方程式__________________________。
(5)B的同分异构体很多,符合下列条件的异构体有______________种。
①苯的衍生物②含有羧基和羟基③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图。
X、Y、Z、W四种化合物均由常见元素组成,其中X含有四种元素,Y、Z含有三种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有右图转化关系(部分反应物、产物及反应条件已略去)。请回答: 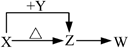
(1)W的分子式是
(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。(该气体可以使带火星的木条复燃)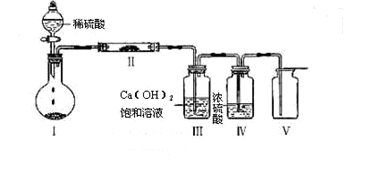
①装置Ⅰ中反应的化学方程式是,
装置Ⅱ中物质的化学式是。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是,所需仪器装置是
(从上图中选择必要装置,填写编号)。
向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X和另一种物质生成,该反应的化学方程式是
下图所示物质中(部分产物和反应条件未标出),只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。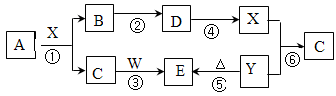
据此回答下列问题:
(1)物质W的名称为,由B生成D的化学方程式为。
(2)请写出X和 Y反应的离子方程式:。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为。
(5)请写出C和W反应的化学方程式:。在这个反应中生成1mol气体转移电子的物质的量为。
1 (6分)有以下几种物质
①乙醇②MgCl2晶体③蔗糖④铜⑤食盐水⑥BaSO4
请填空回答(填序号)。
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中属于非电解质的是。
2.(4分)现有CO和CO2的混合气体18g,充分与氧气反应后测得所得到的CO2的总体积为11.2L(标准状况)。试计算
(1)原混合气体中CO2的体积(标准状况)是,
(2)原混合气体在标准状况下的密度是g/L (结果保留一位小数)