在等物质的量浓度的两种弱酸的钠盐(NaR、NaR′)溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O====HR+NaHCO3,2NaR′+CO2+H2O====2HR′+ Na2CO3,把HR和HR′在水中电离出H+的能力作比较,正确的判断是( )
| A.HR较强 | B.HR′较强 | C.两者相同 | D.无法比较 |
下列说法正确的是
| A.SO2的水溶液能导电,所以SO2是电解质 |
| B.CaCO3的水溶液不能导电,所以CaCO3是非电解质 |
| C.浓度均为0.1mol/L的盐酸和氢氧化钠溶液等体积混合,混合后溶液导电性不变 |
| D.向0.2mol/L的氯化钡溶液中逐滴滴入同浓度的硫酸钠溶液至过量,溶液的导电性先减小后增大 |
下列做法正确的是
| A.将250g CuSO4·5H2O溶于水,制成1L溶液,则该溶液的物质的量浓度为1mol·L-1 |
| B.将160g CuSO4溶于1L水,所得溶液的物质的量浓度为1mol·L-1 |
| C.将NaOH直接放在托盘上称NaOH的质量 |
| D.用量筒量取20.21mL质量分数为98%的浓H2SO4 |
在1500C加热高氯酸铵发生分解反应:2NH4ClO4=N2+Cl2+2O2+4H2O,在1500C时其气态生成物组成的混合气的平均相对分子质量为
| A.71.75 | B.29.375 | C.14.69 | D.无法计算 |
标准状况下在体积为1L的干燥烧瓶中,用排空气法收集HCl气体,将烧瓶倒置于装有足量水的水槽中,不考虑烧瓶内液体与水槽中液体的扩散,则烧瓶中所得溶液的物质的量浓度是:
| A.0.045mol/L | B.0.0224 mol/L | C.0.017 mol/L | D.0.059 mol/L |
在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO42-的物质的量浓度为(单位为 mol·L-1)
A.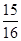 d d |
B.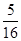 d d |
C.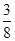 d d |
D.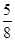 d d |