(1)近年来,化合物的种类增长得很快,其总数已经超过了_____万种;其中大多数是_____(选填:①地球上原来就有的 ②科学家人工合成的);形成这些化合物的元素仅有_____多种。
(2)人类对化学的研究经历了古代化学、 、 三个阶段。在微观层面上操纵分子和原子是 才能研究的内容。
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验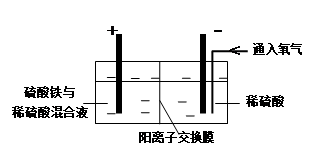
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是;加入有机萃取剂的目的是。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是。
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol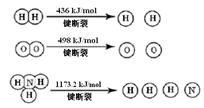
计算断裂1 mol N≡N键需要能量kJ , 氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) =" 2NO" (g)ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙、丙三种方式分别投料, 发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
| 丙 |
0 |
0 |
4 |
判断乙容器中反应进行的方向。(填“正向”或“逆向”)
达平衡时,甲、乙、丙三容器中NH3的体积分数大小顺序为。
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式。
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为。
(3)下列措施能增强84消毒液杀菌能力的是。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为。
下图是部分短周期元素的常见化合价与原子序数的关系图: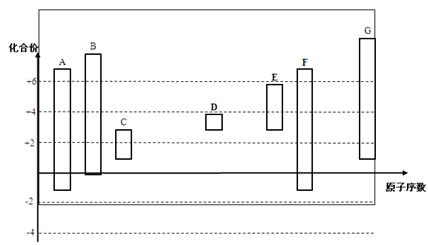
(1)元素A在周期表中的位置。
(2)用电子式表示D2G的形成过程其所含化学键类型为。
(3)C2-、D+、G2-离子半径大小顺序是>>(用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。 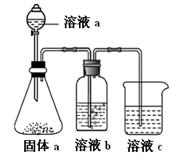
① 溶液a和b分别为,。
② 溶液c中的离子方程式为。
③请从原子结构的角度解释非金属性B > A的原因。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为。
② 用一个离子方程式表示该反应。
聚酯纤维是目前产量第一的合成纤维。它可通过如下路线合成:
已知:①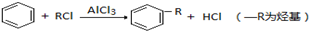
②
回答下列问题:
(1)若W的核磁共振氢谱显示有两个峰,峰值面积比是2 :3。
①W物质的结构简式为。
②生成W的反应类型为。
③J物质所含官能团的名称是。
(2)若G的摩尔质量是116g/mol,其分子中含C为41.4%、含O为55.2%,其余为氢元素。下列叙述中不正确的有。
a. A的同系物中可能存在顺反异构现象
b. 反应I需要在NaOH的乙醇溶液中完成
c. W与A均能使酸性KMnO4溶液褪色
d. 在B中滴加AgNO3溶液不会产生淡黄色沉淀
(3)完成化学方程式
①C→D:。
②反应II:。
③形成G:。
(4)①J有多种同分异构体,满足以下条件J的同分异构体的个数是;
a.遇FeCl3溶液呈紫色; b.能发生银镜反应; c.1mol J能与最多3molNaOH反应;
②若1mol J最多能与4 molNaOH反应,写出J所有同分异构体的结构简式:。
③生产中为提高产品质量,将粗品J溶于热水、过滤、,获得J的精品。